大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
肺癌は本邦の癌死因において男性で1位、女性の2位を占め、非常に頻度が高く、対策が急がれる癌腫の一つです。しかしながら2000年以降様々な側面からの研究が進み、固形癌の中でもっとも病態の理解・治療法の開発が進んだ疾患とも言えます。ここでは、遺伝子変異の蓄積によって発症する肺癌と、その変異によって非自己となった細胞を認識し排除しようとするヒト免疫の攻防という観点から肺癌の腫瘍環境を見直すと共に、2016年から保険収載となった抗PD-1抗体による免疫療法の作用機序・治療効果を予測するバイオマーカーについて明らかになってきた新たな知見・今後の課題を紹介させて頂きます。
肺癌は病理組織学的に約15%を占める小細胞癌と約80%を占める非小細胞癌に分類され、非小細胞肺癌はさらに腺癌・扁平上皮癌などに分類されます。性別から見ると、男性の肺癌の約40%は腺癌・約40%は扁平上皮癌、女性の肺癌の約70%が腺癌・約15%が扁平上皮癌ということになり、肺癌の大半が腺癌もしくは扁平上皮癌ということになります。
喫煙は、肺癌発症のリスクを上昇させることが良く知られていますが、小細胞肺癌・扁平上皮癌が喫煙と濃厚な関連があるのに対して、喫煙歴の全くない人にも特に腺癌はよく発症することが以前より知られていました。その謎を解く一つの答えとなったのが、同一個人の癌細胞と健康な細胞との遺伝子情報の比較によるゲノム解析から2004年に明らかになったEGFRという癌遺伝子変異の発見でした。さらにこのEGFR変異は、日本をはじめとする東アジア・非喫煙者・女性に多く認められることも分かりました。長期の喫煙が遺伝子にたくさんの傷をつけて肺癌が発症するというシナリオは、過剰な日光の照射に伴う皮膚癌・アスベストの長期暴露による悪性中皮腫など長期的な物理・化学刺激による発癌という類似のメカニズムからも理解しやすいと思われますが、このEGFR変異による発癌においては、たくさん傷がついた末の発癌というよりは、むしろピンポイントでこの遺伝子に変異が入ってしまうと変異の総数(Tumor Mutation Burden:TMB)は少なくても肺癌が生じてしまうというメカニズムが関与しています。EGFR変異の発見以降、肺癌には他にもいくつかピンポイントに変異が生じることで発癌を誘導する癌遺伝子・融合遺伝子が発見され、driver mutation(ドライバー遺伝子変異)と呼ばれるようになりました。このような特定のdriver遺伝子の変異で発癌する肺癌は、その増殖・進展がこの遺伝子のシグナルに強く依存しており(oncogene addiction:癌遺伝子依存と呼ばれます)、このシグナルを特異的に遮断する分子標的薬によって強力に腫瘍の増殖が抑制されることが分かりました。分子標的薬という治療選択肢が新たに加わることで、driver mutationを持つ肺癌、特に肺腺癌に対する治療は飛躍的に進歩しました。
一方、いわゆる喫煙などによって様々な遺伝子の変異(driverに対してpassenger mutation:パッセンジャー遺伝子変異と呼びます)の蓄積によって起こる肺癌においては、変異の総数:TMBは比較的多いものの、driver mutationを持ち合わせるケースは少なく、分子標的薬が適応となる確率は非常に低いことが問題となっていました。このグループの治療に光をあてることになったのが2012年に登場する免疫チェックポイント阻害剤:抗PD-1抗体による免疫療法です。
ここで変異を起こした細胞が徐々にヒト免疫の監視を逃れ癌化するまでの過程を示します(図1)。
| 図1 | 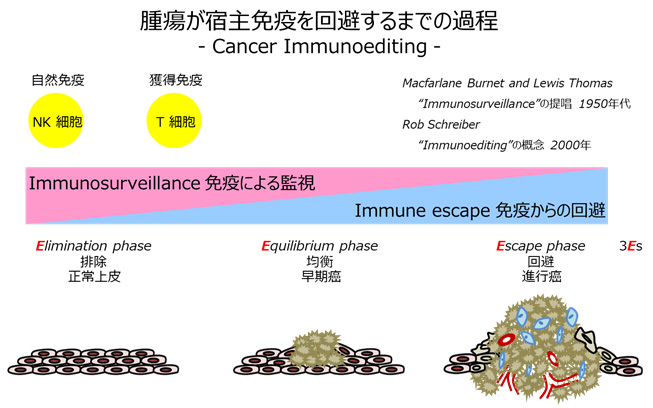 |
通常遺伝子変異が生じた細胞は、異物除去のために働く免疫細胞であるNK細胞やT細胞を中心とする免疫監視機構(Immunosurveillance)によって排除されています(Elimination)。ところが、癌細胞は変異を蓄積していく過程で、宿主の免疫から逃れる術を身につけていきます(Equilibrium)。癌が自ら免疫を逃れるように発達するというよりは、むしろ変異の蓄積でたまたま宿主細胞の免疫監視が作用しない細胞だけが選択されてくるものと考えられます。最終的には免疫監視機構から逃れた癌細胞が増殖・進展していく(Escape)という流れです。
具体的に、マウスモデルなどの研究から明らかになった免疫監視機構からの回避に関わる様々なメカニズムの一部を下記に示します(図2)。
| 図2 | 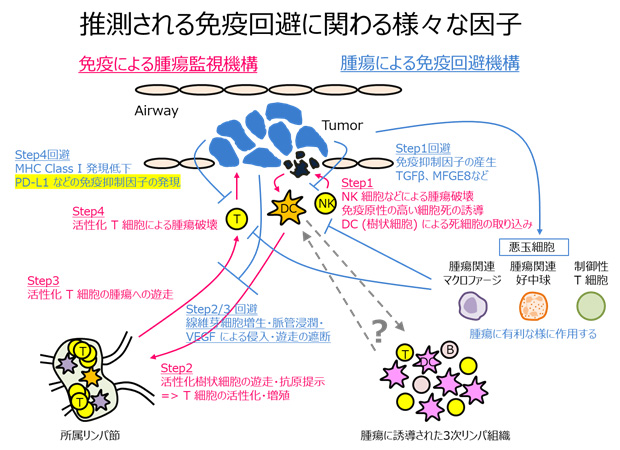 |
腫瘍が宿主の免疫によって排除されるまでのStepを簡単に4つに分けるとします。図2に示すように、その各Stepにおいて実に様々な腫瘍由来の抑制因子が産生されていることが分かると思います。さらにT細胞そのものにもアクセルとブレーキの両方のシステムが搭載されており(図3)、腫瘍細胞上の分子や腫瘍環境の悪玉細胞(図2)がT細胞を直接不活性化する経路も複数存在することが知られています。
| 図3 | 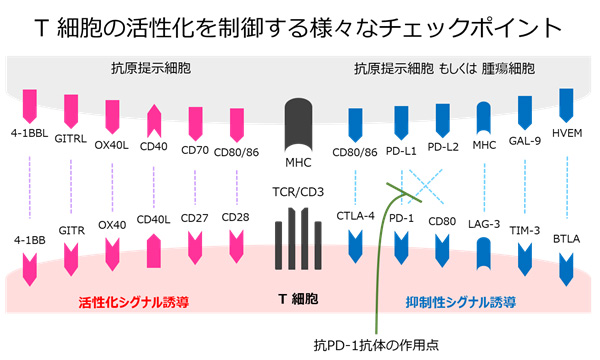 |
図2,3 で示した様に、腫瘍が免疫監視機構を回避するメカニズムについては実に多様な経路が想定されていたため、癌に対する免疫療法においては、どの経路が一番重要か、一つだけでは不十分で複数の標的に対して複合的な治療が必要なのか、など不明な点がたくさんありました。しかしながら、その想定を大きく覆すような衝撃的な臨床試験の結果が報告されます。2012年に登場した免疫チェックポイント阻害薬:抗PD-1抗体による臨床試験です(実際には悪性黒色腫に対する抗CTLA-4抗体が先行しておりましたが、ここでは肺癌に焦点を絞ります)。2016年から本邦でも非小細胞肺癌に対して保険収載となった抗PD-1抗体は、T細胞上のPD-1と腫瘍・免疫細胞上のPD-L1/L2との相互作用(以下PD-1:PD-L1/L2と記載します)を遮断し、T細胞が不活性化するのを抑える役目を果たします(図3)。また図2で示すところのStep4:活性化T細胞の腫瘍破壊、における回避機構に作用すると考えられます。想定された複雑な免疫回避機構の中で、このPD-1:PD-L1/L2というたった一つの経路を遮断するだけで、治療効果を示す肺癌が約20%も存在するということが分かり、これまでの腫瘍による免疫回避機構のドクマは大きく覆されました。また劇的な治療効果が認められた症例では、2 年間の治療終了後も長期に渡って治療効果が維持されることが報告され、さらなる驚きとなりました。
前項で記載したとおり、腫瘍が免疫から回避する機構には様々な経路が想定されていました。たとえ抗PD-1抗体が有効であるとしても、その他の経路が働いていないわけではなく、治療効果が全体の20%という状況からも個々の症例においてPD-1:PD-L1/L2以外の経路がどのように治療効果に影響しているのか検証することが重要と考えられます(それが新たな治療標的となるからです)。抗PD-1抗体は高価な薬剤ですし、投与しても80%の患者様には効果がないということでは、医療経済的な問題や期待できない治療をしている間に他の優先されるべき治療の開始が遅れてしまうなどの弊害が発生してしまいます。そこで開発が急がれたのが、治療効果がある程度期待できる患者を予め予測することが可能なバイオマーカーです。分子標的薬の適応を検討するために標的となるEGFR変異などのDirver遺伝子変異を検査する場合と異なり、先の様な複雑な免疫システムが関与している状況では、確実に免疫治療の効果を予測するバイオマーカーを得ることはほぼ不可能と考えられます。現在臨床の現場で用いられているのは採取した癌組織を免疫染色という検査を用いてPD-L1の発現を評価するというもので、その結果をTumor Proportion Score:TPS として表現します。PD-L1高発現(TPS≧50%)の非小細胞肺癌では、これまでdriver mutationを持たない場合の第一選択として行われていた白金製剤と新規抗がん剤の併用化学療法と比較して、抗PD-1抗体による治療の優位性が証明され、2017年4月より本邦でもバイオマーカーとしてルーチンに検査される項目となりました。
PD-L1 だけでなく、遺伝学および免疫学の観点からの研究により、実際、免疫療法の効果を発揮するための腫瘍内へ浸潤しているリンパ球(Tumor Infiltrating Lymphocytes:TILs)の数や、腫瘍が持っている遺伝子変異の総数(Tumor Mutation Burden:TMB)、特に喫煙などによって誘導されやすい transversion mutationが多いことが治療効果が高いグループを選別できるバイオマーカーとして報告されるようになりました。今後実際に臨床の現場で取り入れられるかについてはまだ検討の余地がありそうです。
PD-L1の発現は肺癌組織診断の際に、ルーチンで評価する項目となりましたが、治療効果予測のバイオマーカーとしての有用性は高いものの、その不完全性もしばしば議論されます。図4に示すように、肺癌に限らず全ての固形腫瘍は、腫瘍内で遺伝子変異の不均一性(intratumoral heterogeneity)を必ずある程度の割合で保有していると考えられます。その遺伝子変異のバラツキによって、免疫監視に見つかりやすい部分とそうでない部分が生まれてしまいます。免疫監視に見つかりやすい部分には浸潤リンパ球があつまり、様々な抗腫瘍活性を誘導するサイトカインを放出し、その影響でPD-L1の発現が局所的に誘導されます。この場合、PD-L1発現に濃度勾配の様なバラツキが生じ、同じ腫瘍でもPD-L1発現が高い部分と低い部分が出現してしまうことになります。図4は、あくまで簡単な例を示しているに過ぎませんが、実際の腫瘍内ではもっと複雑な経路でPD-L1発現のバラツキが生じているものと考えられます。実際に気管支鏡検査などで組織診断のために採取される生検検体の大きさは非常に小さいものなので、たまたまPD-L1発現の低い部分を採取してしまうということも容易に予測されます。以上のような背景があることを十分に理解し、臨床経過と合わせながら実際の免疫療法の適応を考えることが望まれます。
| 図4 | 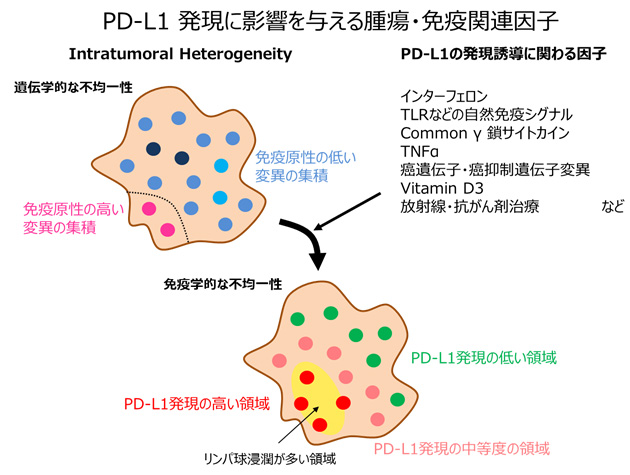 |
前述のとおり、これまでの手術・放射線治療・化学療法に加え、2004年のEGFR変異の発見を契機とした分子標的薬の導入、2012年のPD-1:PD-L1/L2遮断による抗腫瘍効果の発見による抗PD-1抗体の導入により非小細胞肺癌に対する治療選択肢は大きく拡大しました。しかしながら、治療に対する耐性化の問題や、いずれの治療にも効果を示さない患者が依然として多く存在することなど克服すべき課題は山積しています。当研究室では、肺癌マウスモデルや実際の患者検体の解析によって得られた知見に基づき、最適な治療の組み合わせの検証・新たな治療標的の探索を通じ、より多くの肺癌患者が恩恵を受けられる治療の糸口を見出すため全力で研究に取り組んでおります。(作成者:小山 正平, 2017年10月)