大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
近年、生命現象や疾病の分子機構を解明するための研究手法として、網羅的に分子を解析するオミックスの手法が盛んに行われている。また、このオミックスデータをバイオインフォマティクスで解析することにより、“P4 medicine”(predictive 予測的, preventive 予防的, personalized 個別化, and participatory参加型)の実現が期待されている。なかでも、細胞や組織内に発現しているあらゆるタンパク質を同定し、個々のタンパク質の機能およびそれらのタンパクどうしの機能的つながりを網羅的に解析するプロテオミクスが注目されている。質量分析装置の発達により、信頼に足る標準化されたプロテオーム解析が可能となってきており、血液や組織などの複雑性を紐解くことも夢ではない。呼吸器領域においては、肺癌やCOPD、間質性肺炎などの未だに根治が困難な疾患を早期に発見し、適切に治療することが求められている。これらの慢性疾患は、遺伝要因と環境要因が相互作用して形成された分子ネットワークの調節不全で発症するため、このようなヘテロな疾患の病態解明やその先にある個別化医療に欠かせないのが網羅的解析によるバイオマーカーの開発である。
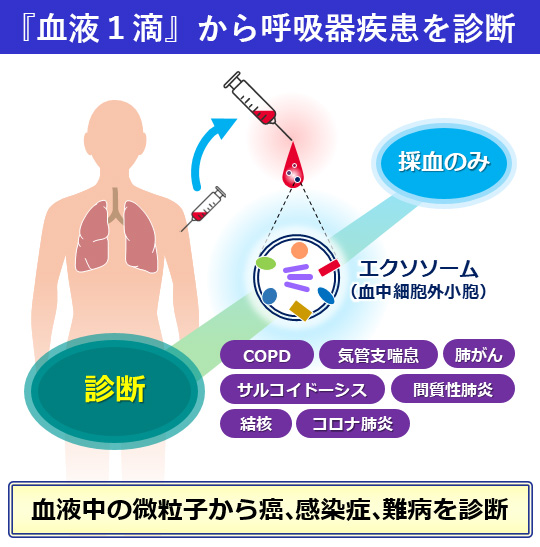
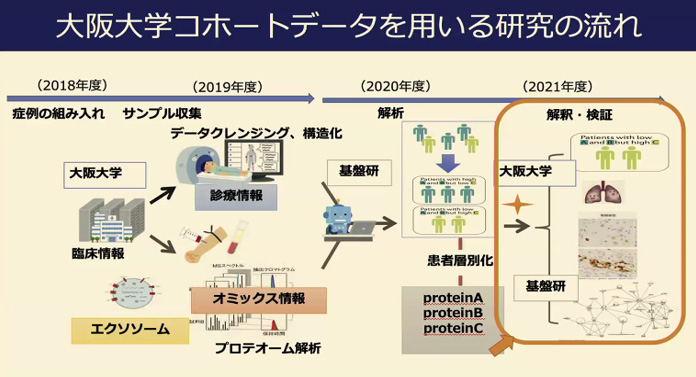
このような背景をもとに、当教室では種々の呼吸器疾患におけるプロテオミクスを用いたバイオマーカー探索に取り組むことで、個別化医療への応用に挑戦している(図1)。
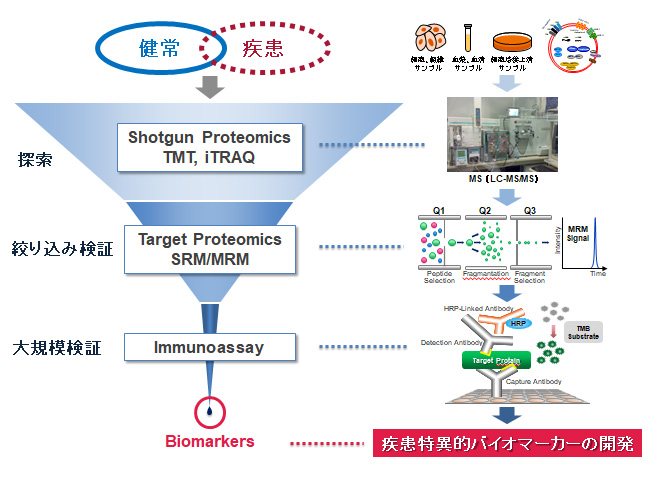 図1.1滴の血液から呼吸器疾患を診断 |
|---|
1 COPD、気管支喘息
2 間質性肺炎
3 感染症(肺炎、真菌症、結核)
4 難病(LAM、サルコイドーシス)
5 呼吸器悪性腫瘍(肺癌、その他)
6 種々の膠原病、血管炎
(1)マウスモデルとヒトから最新プロテオームで紐解く新規COPDバイオマーカー開発
超遠心法により単離した血清エクソソームについて、最新プロテオミクスを駆使したアプローチからマウスとヒトに共通した世界初のCOPD(肺気腫)バイオマーカー:Fibulin-3を同定しました。肺の弾性線維の構成成分であるフィブリン-3は、一秒量低下や肺気腫(CT)の広がりと相関するだけでなく、COPD病変部において発現増加を示しました。今まで呼吸器疾患におけるFibulin-3の役割が不明であることから、遺伝子欠損マウスを作成すると、無刺激で加齢とともに肺気腫(COPD)を発症しました。世界死亡原因の第3位とされるCOPDにおいて、未だに有望なバイオマーカーが同定されていませんでしたが、私たちのアプローチから病態と密接に関わる新規BMが同定されました、今後は、診断薬として臨床応用の可能性を検討するとともに、Fibulin-3のCOPD発症における病態解明や新規治療薬の可能性について検討を進めていく予定です。同時に、このアプローチから、炎症性肺疾患や難病の新規BM解明にも取り組んでいます。
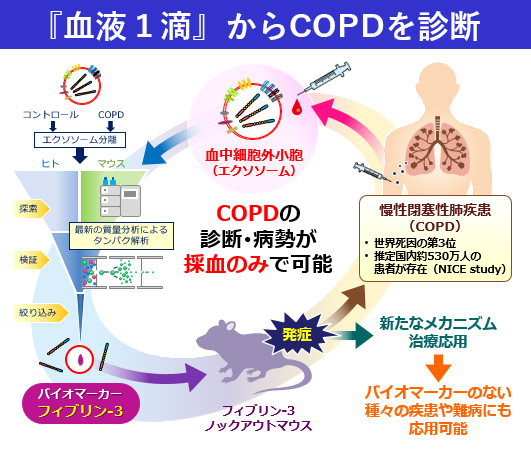 エクソソームの最新プロテオミクスによる新規BM同定 |
|---|
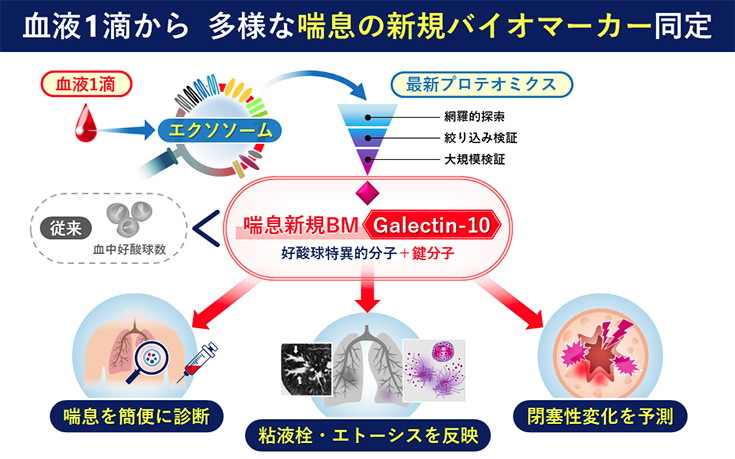
(2)複雑多様な気管支喘息における組織病変を反映する新規BM同定
気管支喘息は、複雑多様な病態が徐々に解明され生物学的製剤も活用可能であるものの、これら多様な表現型を同定する有用なバイオマーカーの開発が不十分であった。マグキャプチャー法により単離された血清由来細胞外小胞(エクソソーム)の最新プロテオミクス(DIA)により、3000種類以上に及ぶ膨大な蛋白を捉えるだけでなく、喘息患者肺のプロテオミクスの比較解析により、喘息病態と密接に関わる新規BMを同定することに成功しました。とりわけ、Galectin-10を含む新規BM分子は、診断や気流閉塞(粘液栓)だけでなく、喘息病態と密接に関わるエトーシスと相関することを見出しました。さらに、Galectin-10は喘息に合併することの多い好酸球性副鼻腔炎におけるポリープ内病変とも相関することを検証し、種々のType2炎症(好酸球性炎症)への有用性が期待される。複雑多様な喘息において、本成果から見出された新規BMは、喘息の診断だけでなく、病態解明や治療法開発に有用であることが示唆されました。
 |
|---|
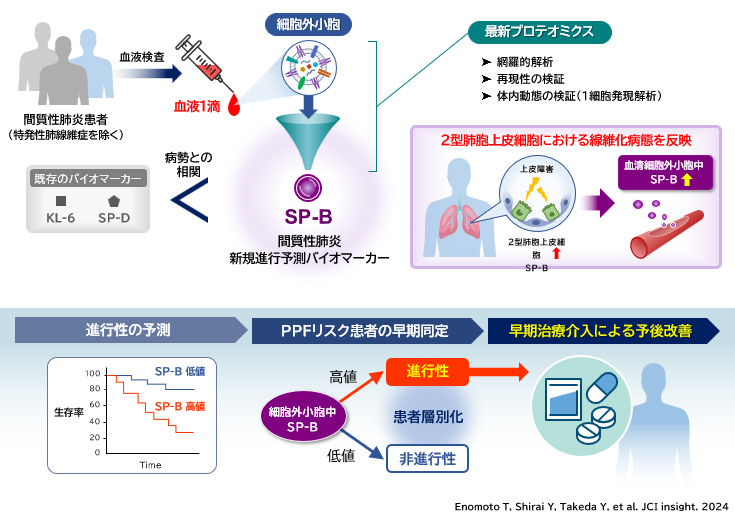
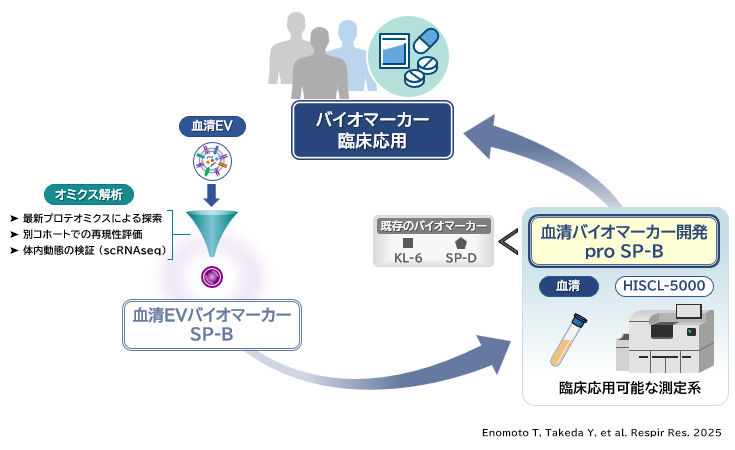
(3)1. 進行性肺線維症(PPF)における進行性予測バイオマーカーを同定
間質性肺炎は慢性経過で肺に線維化をきたす難病とされ、抗線維化薬を含む治療を行っても予後不良である。線維化の進行を抑えるために早期治療が望まれているものの、その進行を予測することが難しく、治療開始が遅れるケースも多い。内閣府主導プログラムであるPRISMにおける検討から、細胞外小胞(エクソソーム)に着目し、最新プロテオミクス(DIA)とシングルセル解析を駆使することにより、間質性肺炎の進行を予測可能なバイオマーカーとしてサーファクタント蛋白であるSP-Bを同定した(右図)。血清細胞外小胞中のSP-Bは、従来のバイオマーカーとされる血清KL-6やSP-Dよりも間質性肺炎の病勢と強い相関を示すだけでなく、進行性リスクの高い患者を早期に捉えることが可能であった。血清細胞外小胞のSP-Bを測定することにより、線維化進行のリスクがある患者を見出し、抗線維化薬などを早期から導入することで、予後改善につながることが期待される。
 |
|---|
(3)2. 細胞外小胞から見出したバイオマーカーを血清中でも検出→実用化可能な測定系を構築
血清細胞外小胞(エクソソーム)のプロテオミクスを用いることで、間質性肺炎進行予測バイオマーカーとしてSP-Bを同定したが、血清細胞外小胞をバイオマーカーとして臨床応用するには技術的ハードルが存在する。そこで我々は、実臨床で容易に扱うことのできる血清サンプルを用いて、その中に含まれるSP-Bを間質性肺炎進行予測バイオマーカーとして活用することを目指した。これまでの研究成果から、SP-Bの中でもpro-formが重要である可能性が示唆されたことより、ここでは血清中pro SP-Bの測定系を開発した。血清pro SP-Bは、既存のバイオマーカーである血清KL-6やSP-Dを含む13個のバイオマーカー群の中で、最も死亡率と強い関連を示していた。血清サンプルおよびHISCL-5000という機器を用いたこの測定系は、技術的に即座の臨床応用が可能であり、近い将来の実用化を目指している。このように、細胞外小胞から見出したバイオマーカー分子について、さらに血清バイオマーカーとして実用化可能な測定系を構築することが、臨床応用に向けたさらなる一歩になるものと期待される。
 |
|---|
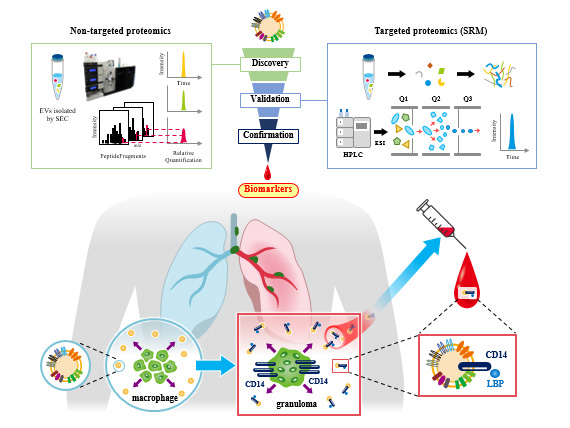
(4)血液1滴から肉芽腫形成を反映する難病サルコイドーシスの新規BM同定
サルコイドーシスは肺、眼、心臓、皮膚などを中心に全身に非乾酪性肉芽腫が形成される原因不明の難病とされています。原因として細菌感染や環境因子、遺伝、ストレスなどの関与があることは分かっていますが詳細な病態解明には未だ至っておりません。無治療で自然に軽快する症例もありますが、線維化を起こし不可逆となり重篤な臓器障害をきたす予後不良例も存在し、非常に多彩な臨床経過を辿ります。実臨床ではすでに2つの血清バイオマーカーが用いられていますが、診断、予後予測という点においては満足できるものではなく新規バイオマーカーの開発が望まれています。
今回、研究グループはサルコイドーシスの新規バイオマーカーを同定するため、血清エクソソームに着目し、サルコイドーシス患者と健常者の血清エクソソームに発現しているタンパク質を網羅的解析により測定、比較し、バイオマーカーとしての精度や病態への関与も含めて検証を重ねました。その結果、CD14、LPS-binding protein(LBP)という2種類のタンパクを新規バイマーカーとして同定しました(図1)。既存のバイオマーカーと組み合わせる事でサルコイドーシスの診断率が向上することが期待されます。またサルコイドーシスの特徴である肉芽腫形成にこれらのタンパク質が深く関わる事が示唆され、病態の解明や新規治療薬開発に繋がる事も期待されます。
 |
|---|
(5)肺MAC症と肺結核を鑑別しうる新規BM同定
肺非結核性抗酸菌(NTM)症は環境中に存在するNTMを原因とする慢性呼吸器疾患であり、その感染者数は世界中で増加しています。肺NTM症の約9割はMycobacterium avium Complex(MAC)という菌が原因です。肺NTM症と肺結核は症状や画像所見が類似しており鑑別が困難であることから、これらを鑑別できる新規バイオマーカーの開発が望まれています。
私たちは血清細胞外小胞を用いたプロテオミクスにより、肺MAC症のバイオマーカーNHERF2を同定しました。さらに肺組織の免疫組織染色により、肺MAC症の肺病変においてNHERF2が強く発現していることを確認しました。NHERF2は生体内でイオンチャネルの制御などの働きを担っており、バイオマーカーのみならず、肺NTM症の病態解明や新規治療戦略の開発につながる可能性が期待されます。
 |
|---|
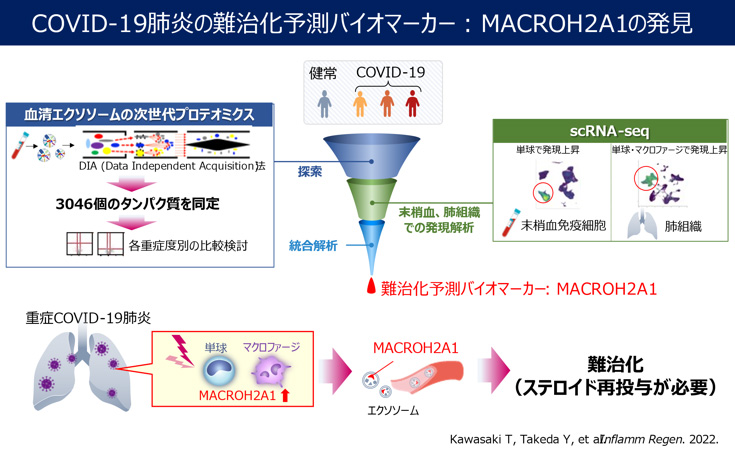
(6)最新プロテオミクスとシングルセル解析の統合解析によるCOVID-19難治化BM同定
新型コロナウイルス感染症(COVID-19)において、通常は重症肺炎に対してステロイドなど抗炎症治療が行われます。しかし、適切な治療を行っても病気が進行する「難治化」ケースを早期に予測する簡便な手法の開発は喫緊の課題でした。
血清エクソソームを用いて、次世代プロテオミクスDIA(Data Independent Acquisition)法により3046種類のエクソソーム蛋白を検出し、その中からステロイド治療抵抗例の予測BMとしてヒストン関連蛋白 MACROH2A1を同定しました。
さらに、末梢血単核球と肺組織を用いたscRNAseqにより、単球・マクロファージにおけるMACROH2A1の発現増加を確認しました。また、プロテオミクスとscRNAseqの統合解析によると、重症COVID-19の病態に、肺や末梢血中単球においてMACROH2A1が関与しているだけでなく、単球由来MACROH2A1が血中エクソソームに反映するため、リキッドバイオプシーとしての有用性も示唆されました。従って、血中MACROH2A1は、難治化BMとしてだけでなく、創薬候補になることも期待されます。
 |
|---|
(7)気管支喘息, COPDの診断に有用な呼気中エクソソームのバイオマーカー同定
気管支喘息は有病率が高い一方で、その診断は容易ではなく、既存の検査のみでは不十分とされます。また、COPDは世界死因の上位であるものの、診断に必須とされる呼吸機能検査はほとんど実施されず、9割が未診断で未治療と報告されます。そこで、より負担の少ない呼気の検査に着目し、エクソソームの最新プロテオミクスを実施したところ、呼気凝縮液中のエクソソームから2500種類以上の膨大な蛋白を捉え、喘息やCOPDの診断バイオマーカーとしての可能性が示唆されました。特に、Peptidase Dなどの蛋白は、喘息においてそれぞれ呼吸機能や末梢血好酸球数、血清Ig Eと相関することを見出しました、 COPDにおいてはGalectin-related protein (LGALSL) などの蛋白は呼吸機能と相関したため、これら2つの閉塞性肺疾患の特徴や多様性を呼気から捉えられる可能性が示唆されました。今後、これらの新規バイオマーカーを簡易に測定できるキットを開発できれば、診断精度の改善が期待されます。さらに、臨床データや血清など従来の診断法と組み合わせることで、個別化医療への活用も期待されます。
 |
|---|
(8)次世代プロテオミクスで紐解く呼吸器疾患と今後の展望
私たちの教室では、オミクス専門家と共同研究することで、次世代プロテオミクスを駆使したアプローチにより種々の炎症性呼吸器疾患、感染症、悪性疾患の新規バイオマーカー同定を同定しています。プロテオミクスだけでなく、ゲノム、トランスクリプトームやメタボロミクスなどのオミクスを統合させるアプローチ(マルチオミクス)も複雑多様な炎症性呼吸器疾患の解明に取り込んでいます。さらに、これら新規BMは肺内病変の活動性を反映することから、エクソソームの網羅的解析は、病態解明だけでなく、個別化医療を目指した創薬への有用性が示唆されました。
 |
|---|
(9)リキッドバイオプシーとしてのエクソソームの有用性を活用した特発性肺線維症における「新薬創出を加速する人工知能の開発」
医薬品開発において、近年国内外を問わず創薬ターゲットの枯渇が問題となっている。更に、臨床試験段階で期待していた薬効が得られず開発が中断する例が増えていることも問題点として挙げられる。特に医薬品開発の70〜80%がPhase2で中止となっており、薬効が得られなかったことが原因の大半を占める。このような現状を打開する解決策として、人工知能(AI; Artificial intelligence)が注目されている。本事業では、「創薬ターゲットの枯渇問題」を克服すべく、動物からではなくヒトの情報から創薬ターゲット分子を探索するAIの開発実装を目的とする。つまり、臨床情報(=電子カルテを始めとする診療情報+オミックスデータ)を収集・利用して創薬ターゲットを探索するAI手法の開発を行うために、オールジャパンの取り組みから、難病IPFにおける世界初のデータベース構築からAIを開発することで、創薬開発に取り組んだ。
当科が長年取り組んできたエクソソーム研究成果は、細胞外小胞プロテオームが呼吸器疾患の肺内病変を反映すること、すなわちLiquid Biopsyとしての有用性である。本プロジェクト(PRISM)では、臨床オミクスとして当科が取り組んできたエクソソームの最新プロテオミクスを駆使することにより、血液1滴から2000種類の蛋白群からなるデータベース構築に成功した。これら世界最大規模の阪大コホートによるデータベースから、患者層別化のためのAI(Subset-Binding)作成に至った(理研 上田修功、医薬基盤研 夏目やよい)。この独自AIから、20種類の新規抗線維化ターゲットを同定するだけでなく、候補薬剤においてin vitro & in vivoにおける抗線維化効果の検証に成功した。これらデータベースと本成果は、国内製薬企業に創薬のタネとしてオープンプラットフォームを構築し、次世代創薬のストラテジーとしても活用を期待する(http://www.imed3.med.osaka-u.ac.jp/research/r-resp09.html)。
 大阪大学コホートによる難病IPFのデータベース構築と創薬開発 |
|---|
| # | 閉塞性肺疾患BM:PCT出願 PCT/JP2018/009502 発明者:武田吉人、熊ノ郷 淳、玄山宗到、植田幸嗣 |
|---|---|
| # | 組織線維化BM:PCT出願 PCT/JP2018/009503 発明者:武田吉人、熊ノ郷 淳、松木隆典、植田幸嗣 |
| # | 慢性閉塞性肺疾患BM:PCT出願 PCT/JP2018/009529 発明者:武田吉人、熊ノ郷 淳、木庭太郎 |
| # | サルコイドーシス BM:PCT出願 PCT/JP2019/ 発明者:武田吉人、熊ノ郷 淳、木庭太郎、二見 悠、植田幸嗣 |
| # | リンパ脈管筋腫症BM:特願 2018-048266 発明者:滝本宜之、武田吉人、熊ノ郷 淳、井上義一 |
| # | 肺線維化疾患バイオマーカー:特願 2021-138300(K20210121) 発明者:武田吉人、白井雄也、榎本貴俊、熊ノ郷 淳 |
| # | 好酸球増多症又は気管支喘息バイオマーカー:特許 K20210187 発明者:吉村華子、武田吉人、熊ノ郷 淳 |
| # | 悪性胸膜中皮腫バイオマーカー:特願 2021-101842(K20200194) 発明者:武田吉人、熊ノ郷 淳、安部祐子 |
| # | IPF層別化マーカーのスクリーニング手法、IPF層別化マーカーおよび創薬標的:特願 K20210423 令和4年3月18日届け出 発明者:武田吉人、熊ノ郷 淳 |
| # | 次世代プロテオミクスおよびシングルセル解析によるCOVID-19肺炎の新規重症化バイオマーカー:特願 2022-167186 発明者:川﨑貴裕、武田吉人、熊ノ郷 淳 |
| # | 肺がんバイオマーカー:特願 2023-124213 発明者:武田吉人、山本 真、菅 泰彦、熊ノ郷 淳 |
| # | 閉塞性肺疾患バイオマーカー:特願2025-003957 発明者:原 怜奈、武田吉人、熊ノ郷 淳 |
| 武田 吉人 | 准教授 |
|---|---|
| 川﨑 貴裕 | 助教 |
| 白井 雄也 | 大学院生 |
| 榎本 貴俊 | 大学院生 |
| 山本 真 | 大学院生 |
| 谷崎 智史 | 大学院生 |
| 中山 真奈 | 技術補佐員 |
| * |
国立研究開発法人 医薬基盤・健康・栄養研究所 プロテオームリサーチプロジェクト:鳴海 良平、足立 淳、朝長 毅 |
|---|---|
| * | がん研究会 がんプレシジョン医療研究センター:植田 幸嗣 |
| * | 刀根山医療センター:森 雅秀、木田 博、松木 隆典 |
| * | 近畿中央呼吸器センター:滝本 宜之、広瀬 雅樹、井上 義一、新井 徹 |
| * | 兵庫医大 呼吸器・血液内科:木島 貴志 |
| * | 大阪大学 薬学部 細胞生理学分野:辻川 和丈、長谷 拓明 |
| * | 九州工業大学 情報工学研究院 山西 芳裕 |
| * | 大阪大学 呼吸器外科 新谷 康 |
大阪大学大学院医学系研究科 呼吸器・免疫内科
呼吸器内科
科長 武田 吉人
Tel: 06-6879-3833
Fax: 06-6879-3839
yoshito@imed3.med.osaka-u.ac.jp
免疫細胞や腫瘍細胞をはじめ、体内のあらゆる細胞から分泌されるエクソソーム(Exosome)と呼ばれる膜小胞顆粒が注目を集めている。脂質二重膜で包まれるエクソソームは、タンパク、核酸や代謝産物を内包するだけでなく、ドナー細胞からレシピエント細胞へと細胞間や臓器間を移動する新たなメッセンジャーとして機能する。さらに、その内容物である蛋白や核酸が標的細胞へ受け渡されて機能することから、生理的状態だけでなく悪性疾患、免疫疾患から感染症に至るまで多くの疾患における病態や治療への可能性がある。エクソソームは、細胞から分泌された脂質二重膜で形成される直径100nm程度の膜小胞顆粒である(1)。生体では、血液、尿、鼻汁、気管支肺胞洗浄液等あらゆる体液中に含まれる。またタンパク質、核酸や脂質など複数の分子を含み、細胞間や組織間のコミュニケーションに寄与することから新たな情報伝達手段として注目されてきた。エクソソームは、細胞質内のエンドソーム膜に出芽することで形成される腔内膜小胞(ILV)に由来し、エクソソームで満たされた多胞体(MVB)は、リソソームと融合すると破壊され、細胞膜と融合することで細胞外へ放出される(図2)。様々な外部ストレス(低酸素、薬剤、喫煙)が、エクソソームの分泌に影響を与えることから、エクソソームの数や質が疾患の活動性を反映する可能性も示唆されている。エクソソームが分泌される過程において、セラミドやエンドソーム輸送選別複合体の関与が考えられている。一方、分泌されたエクソソームは、エンドサイトーシスや膜融合を介した経路で、レシピエントの細胞に取り込まれるなど、少しずつ動態が解明されてきた(2)。
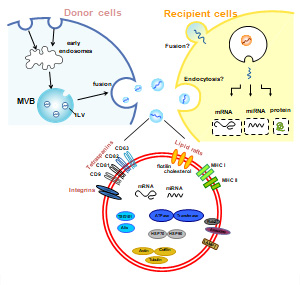 図2.エクソソームの分泌と取り込み |
|---|
エクソソームは、1983年にJohnstoneらが羊の網状赤血球から分泌された小胞に名付けたことが始まりで、不要な細胞内成分を排出する『ゴミ箱』とみなされてきた。ところが2007年、miRNAやタンパク質を内包したエクソソームが、受け手の細胞に取り込まれるだけでなく、その情報が機能することから一躍脚光を浴びた(3)。エクソソームには、テトラスパニン(CD9, CD63)やflotilinなどのマーカー蛋白が発現しているため、これらの分子を利用した単離法も開発されている。さらにエクソソームは分泌する細胞、組織や疾患により、組成(蛋白や核酸)が変化することから、バイオマーカーとして注目されている。例えばエクソソーム中のmiRNA解析から、腫瘍の有無、起源や病勢を推測することで診断への応用が期待されている。さらにプロテオミクスやマイクロアレイから疾患活動性や治療反応性を予測することも可能である。
腫瘍の進展には腫瘍そのものだけでなく、腫瘍微小環境の重要性が益々高まっているものの、細胞間相互作用については十分理解されていない。最近、エクソソームが 1. 転移、2. 免疫修飾、3. 腫瘍周囲の線維芽細胞やマクロファージへの作用、4. 抗癌剤耐性、5. 血管新生などの様々なステップにおいて重要な一端を担っていることが明らかになってきた(4,図3)。
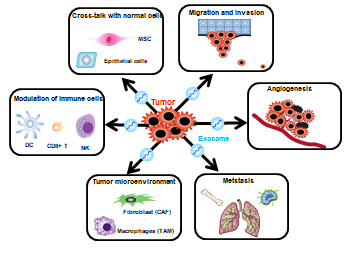 図3.癌の悪性化、進展におけるエクソソームの役割 |
|---|
例えば、エクソソームの分泌を促進的に作用するsmall GTP結合蛋白、Rab27Aの発現を抑制した腫瘍細胞は、マウスに移植すると親株に比べて腫瘍増大と転移が抑制することが示された(5)。さらに、高転移性のメラノーマ細胞株をマウスに移植すると、肺や肝臓に転移しやすい。そのメカニズムとして、高転移性の癌細胞由来のエクソソームが骨髄細胞に影響し、その骨髄細胞が転移巣(肺)における下地を整えることで腫瘍の増大と転移を促進することが示された(6)。病態形成や治療応用だけでなく、バイオマーカーのリソースとして癌領域ではエクソソーム研究が特に進んでいる。肺癌患者において6種類のmicroRNAを用いることで、肺腺癌と非癌疾患を鑑別できることも報告された(7)。プロテオミクスは、遺伝子に比べて解析法が確立していないことや、増幅ができないために最も研究が遅れている。しかし、抗CD9抗体固相化チップを用いた単離法により、肺腺癌のマーカー蛋白(CD91, CD317)も見出された(8)。
エクソソームは、生体内抗原や抗原ペプチド/MHC複合体が含まれていることから、免疫細胞間での抗原情報の交換や、免疫細胞の活性化など様々な免疫応答を制御することが示されている。実際、慢性関節リウマチを含む種々の自己免疫性疾患において、エクソソームを含む細胞外小胞は自己抗原を含み、炎症や免疫を誘導することが示された(9)。サルコイド―シス患者では健常人に比べて、BALF由来のエクソソームが増加しているだけでなく、MHC分子やテトラスパニン(CD9,CD81)の発現増加が観察された(10)。喘息患者におけるBAL由来のエクソソームは、蛋白の質的変化と、気道上皮細胞からのロイコトリエン(LTC4)やIL-8の産生誘導を示した(11)。さらに、BAL由来エクソソームのマイクロアレイ解析により、let-7 and miRNA-200を含む16種類のmiRNAsは、喘息の新規バイオマーカーになることが報告された(12)。このように、種々の呼吸器疾患においても、エクソソームの役割が徐々に解明されている。
創薬における核酸医薬が注目されるなか、エクソソームは新たなドラッグデリバリーシステム(DDS)としても注目されている。神経細胞特異的に結合するペプチドとエクソソーム膜分子のキメラタンパクを恒常的に発現する樹状細胞由来のエクソソームを作成し、siRNAを搭載後にマウスへ投与することで、脳組織でsiRNA特異的にmRNAや蛋白の発現が抑制された(13)。この結果は、エクソソームの膜表面の修飾と内部への核酸封入により、標的分子を制御できるだけでなく、標的とする細胞(レシピエント)も決めることができることをあらわす。間葉系幹細胞(MSC)は様々な疾患に対する細胞治療のソースとして注目されるが、MSC由来のエクソソームも治療手段として期待されている(14,図4)。今後、種々の問題点が解決されれば、エクソソームが、安全で特異性の高いDDSになることが期待される。
 図4.エクソソームの治療応用 |
|---|