テトラスパニンと呼吸器疾患
Tetraspanins research
(1)ユニークなタンパクファミリー「テトラスパニン」とは
テトラスパニンは、細胞膜を4回貫通する構造を持つ膜タンパクファミリーで、ヒトではCD9、CD63、CD81、CD82、CD151など33種類のメンバーが知られています。テトラスパニンの機能は、一言でいえば他の膜タンパクと結合してコンプレックスを形成することです。そのためmolecular facilitatorとかmolecular organizerと呼ばれています。例えばテトラスパニンCD9はEWI-2と、CD81はCD19と、CD151はintegrin α3β1と結合してペアーを形成します。さらにテトラスパニンどうしもゆるく結合しあって大きなコンプレックスとなり、細胞膜上にテトラスパニンの豊富なマイクロドメイン(tetraspanin-enriched microdomain, TEM)を構築します。TEMにおいてテトラスパニンがインテグリンなどの機能分子を整然と配置することで、細胞内に正しくシグナルが送られ、細胞運動や細胞融合など細胞骨格のダイナミクスがうまくコントロールされています。インテグリンの主要パートナーとして自己免疫疾患、神経疾患、感染症、悪性腫瘍における機能解明が進み、治療応用の可能性が次々に報告されています(Nat Rev Drug Discov. 2008 Martin Hemler.)。
(図1)テトラスパニンの構造
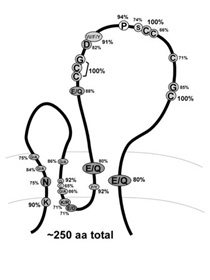 |
(図2)テトラスパニンファミリー
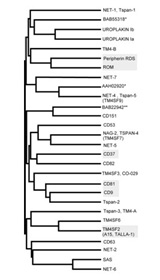 |
(2)テトラスパニンと炎症
テトラスパニンが、肺の炎症にどのように関与しているか調べるために、骨髄由来マクロファージを用いてLPSに対する反応を比較しました。CD9ノックアウトマウスのマクロファージをLPSで刺激すると、WTに比べ強い活性化が見られました。LPSの刺激により、CD14やTLR4を主体とする分子の配置が変わり、脂質ラフトと呼ばれる膜ミクロ領域でCD14/TLR4コンプレックスを形成して伝わることが知られています(下図)。我々はCD9ノックアウトマウスではCD14とTLR4の分布が変化し、ラフトにおけるCD14/TLR4コンプレックスの形成が増強していることを見出しました(業績 9、J Immunol. 2009)。実際にCD9ノックアウトマウスにLPSを経鼻投与すると、マクロファージを主体とした炎症細胞の増加を認めました。以上の結果から、テトラスパニンはラフトの分子などと相互作用し、膜の配置を整えることにより炎症を制御している可能性が示唆されました。
(図3)テトラスパニンCD9による抗炎症作用 (J Immunol. 2009)
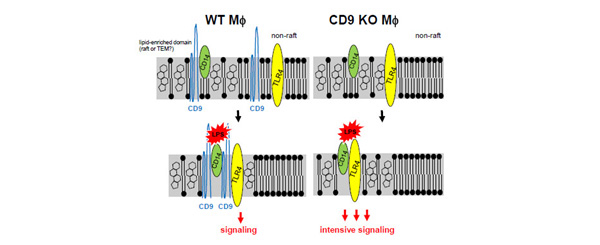 |
(3)テトラスパニンとCOPD 『CD9/CD81二重欠損マウスは、肺気腫自然発症モデル』
大阪大学微生物病研究所細胞機能分野 目加田英輔教授との共同研究でCD9とCD81を同時に欠失させたCD9/CD81ダブルノックアウトマウスを作成したところ、加齢とともに肺胞破壊とマクロファージ主体の炎症細胞浸潤を伴う肺気腫病変を示しました(業績4:JCB 2003, 業績8: JBC 2008)。そのメカニズムとして、マクロファージの走化性異常とプロテアーゼ(MMP-9)の過剰産生が示唆された。興味あることに、 COPD 患者の末梢血から単離した単球においては、CD9やCD81の発現低下を見出しました。
COPDは、体重減少や筋肉萎縮、骨粗鬆症などを高率に合併し、全身性疾患と捉えることが強調されていますが、このDKOマウスは、無刺激で肺気腫を示すだけでなく、体重減少や骨粗鬆症も伴うCOPD患者に類似したマウスであると考えられます(図4)。
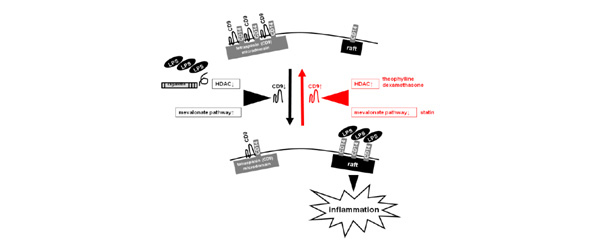
以上の結果から、CD9 やCD81 の発現を増強させる薬剤を見つければ、 COPD の治療に繋がることも期待されます。そこで、私たちは COPD が全身性疾患であることから、既存薬にテトラスパニン の発現増強薬があるのではないかと考え、臨床で応用されている1200 種の薬剤を含む既存薬ライブラリーをスクリーニングしました。その結果、CD9とCD81の発現を増強する薬剤としてスタチンを同定しました(業績16, PLoS One. 2013)。さらに、新しい炎症メカニズムとして、メバロン酸経路の活性化やLPS による HDAC 抑制がマクロファージ CD9 を低下させ、炎症を増強することを提唱しました(下図5)。メバロン酸経路を抑制するスタチン、HDAC を活性化するテオフィリンとデキサメタゾンは CD9 発現を増強して抗炎症効果を発揮すると考えられます。
(図4)CD9/CD81二重欠損マウスの表現型 (JCB 2003, JBC 2008)
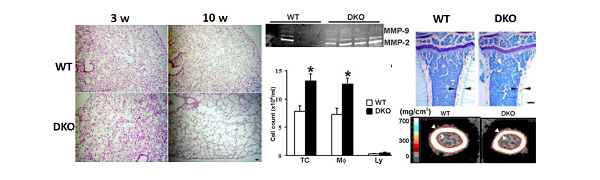 |
(図5)CD9を介した炎症制御機構 (PLoS One. 2013)
 |
(4)テトラスパニンと肺線維症『CD151欠損マウスは、肺線維症自然発症モデル』
テトラスパニンCD151は上皮細胞に強く発現しており、これまで上皮の形態保持に重要であることが示唆されています。私たちは、CD151 KOマウスを用いた解析により、無刺激で加齢とともに肺線維症に至ること、BLM刺激によりさらなる線維化の増強を示し、その発症機序として肺胞上皮におけるCD151が基底膜への安定な接着を保持することで上皮integrityを保持していることを見出しました(業績12:AJRCCM 2012)。興味あることに、ヒト肺線維症患者においても、II型肺胞上皮細胞におけるCD151の発現低下を認めました(近畿中央胸部疾患センター、井上義一先生との共同研究)。
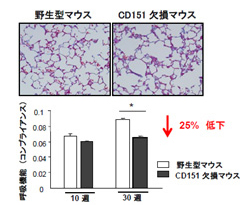
(図6)CD151 KOマウスは肺線維症を示す |
以上の結果は、CD151が肺で欠損・低下すると肺胞上皮細胞に異常をきたし、肺の線維化が形成されることを示唆します。CD151 KOマウスにおける線維化形成は、加齢や、ブレオマイシン等の肺胞上皮を傷害し得る外部からの刺激によりさらに増強することも示されました。今後 CD151は肺線維症のメカニズム解明の糸口、ならびに新規治療のターゲットとなり得ると考えられます。
最近、CD151の鍵となるパートナーであるIntegrin α3の遺伝子異常の患者が間質性肺炎を発症することが報告されたため(NEJM 2012)、テトラスパニンCD151についても注目されることが期待されます。
(5)テトラスパニンと老化
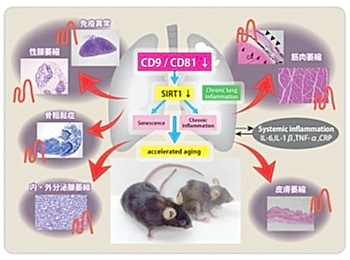
(図7)多様な老化表現型を示すCD9/CD81 DKOマウス |
COPDや肺線維症などの慢性炎症性疾患の病態基盤は、老化メカニズムと共通点が多いことが知られています。なかでも、全身性炎症性疾患であるCOPDは、『肺の老化』や『老化促進肺』と考えられるようになったものの、老化とCOPDとの関連については十分解明されていません。ヒト類似のCOPD様表現型を示すCD9/CD81 DKOマウスの長期にわたる観察により、肺気腫や骨粗鬆症だけでなく、様々な老化表現型(白内障、皮膚萎縮、性腺萎縮、胸腺萎縮、筋肉萎縮、短命)を示す老化促進型マウスであることを見出しました(業績17)。さらに、本マウスが老化を示すメカニズムとして、テトラスパニンCD9とCD81の発現低下により、抗老化分子として重要なサーチュイン(SIRT-1)の発現が低下し、これがアポトーシスや慢性炎症を誘導することを突き止めました。すなわち、肺において重要な機能(COPDのブレーキ役)をしているテトラスパニンが、老化鍵分子(サーチュイン)の発現を維持することで、『老化のブレーキ役』としても働いていることが示されました。
以上のことから、テトラスパニンの発現や機能を亢進させる薬剤の開発は、COPDだけでなく、アンチエイジングに繋がることも期待されます。
(6)テトラスパニンと肺癌
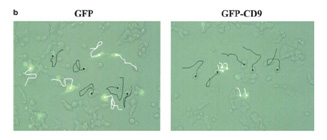
小細胞肺癌は、早期から所属リンパ節や遠隔臓器に転移を起こします。また、インテグリンを介する細胞外基質への接着により神経細胞様の分化を示し、これにより抗癌剤によって引き起こされるアポトーシスから免れています。テトラスパニンCD9 やCD82 は、癌細胞の運動・浸潤を低下させることで癌の転移を抑制することが知られています。私たちは肺癌培養株におけるテトラスパニンの発現を調べ、大部分の小細胞肺癌で CD9 の発現が低下し、CD9 を小細胞肺癌に発現させると細胞運動が低下することを見出しました(図8、Oncogene. 2003)。さらに、血清非存在下では、CD9 の発現は小細胞肺癌のアポトーシスを誘導しました(図9、Cancer Res. 2006)。最近私たちは神経タンパクであるカルレティニンが、CD9 の下流でアポトーシスを促進することも見出しました(FEBS Open Bio. 2013)。これらの成果から、転移抑制因子CD9が発現していないことが、小細胞肺癌の高い悪性度に寄与していると考えられました。CD9には遺伝子異常が見つかっておらず、何らかの理由で小細胞肺癌ではその発現がswitch-offされていると考えられます。そこでCD9の発現をswitch-onさせる方法がないかを検討することが今後の課題です。
(図8)小細胞肺癌におけるCD9による運動制御
 |
(図9)小細胞肺癌におけるCD9とアポトーシス
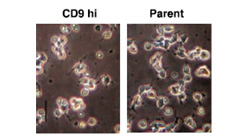 |
(7)テトラスパニンと血管新生・リンパ管新生
近年、血管新生をターゲットにした治療が、多くの癌種において臨床応用されています。テトラスパニンは腫瘍だけでなく腫瘍を取り囲む微小環境を構成する細胞(血管内皮、線維芽細胞、マクロファージ)にも様々な程度で発現しています。例えばCD151 KOマウスによる解析から、血管内皮細胞におけるテトラスパニンCD151は、血管新生を促進することで、肺癌細胞の進展を促進することを見出しました(業績7: Blood. 2007)。さらに、宿主における血管内皮細胞のCD151は、癌細胞が他の臓器に転移するための足場となることを見出しました(業績11: Blood. 2007)。CD151は、癌細胞において腫瘍促進的に作用することが報告されていましたが、宿主においても癌の増殖・進展や転移に促進的に作用するため、有効な治療標的になることが期待されます。
次に、私たちは生体を構成するもう一つの脈管であるリンパ管におけるテトラスパニンの機能について検討を加えました。リンパ管内皮細胞には、CD9が高発現しており、CD9 KOマウスではin vitroと in vivoにおいてリンパ管新生が低下していることを見出しました(業績13: J Biol Chem. 2013)。さらにそのメカニズムとして、リンパ管形成に鍵となる増殖因子VEGFR-3とインテグリンの会合をCD9が促進していることが示唆されました。驚くべきことに、CD9と相同性の高いCD81を同時に欠失させたDKOマウスにおいては、気管支リンパ管網の低形成を認めました(図10)。以上より、テトラスパニンは、腫瘍細胞だけでなく、血管やリンパ管を含む腫瘍微小環境においても機能していることが示されました。
生体のなかで最も重要な接着分子であるインテグリンは、悪性疾患だけでなく炎症性肺疾患においても臨床応用(抗接着分子療法)が進んでいます。テトラスパニンは、1990年代にインテグリンパートナーとして発見されてから約30年経過するものの、十分な解明がされていません。インテグリンの主要パートナーとして、インテグリンや増殖因子受容体を含む多くの膜蛋白の恒常性維持を巧妙に制御しているテトラスパニンを標的とする治療が、将来実現することを期待しています(Nat Rev Drug Discov. 2008 Martin Hemler)。
(図10)テトラスパニンによるリンパ管形成の制御機構(J Biol Chem. 2013)
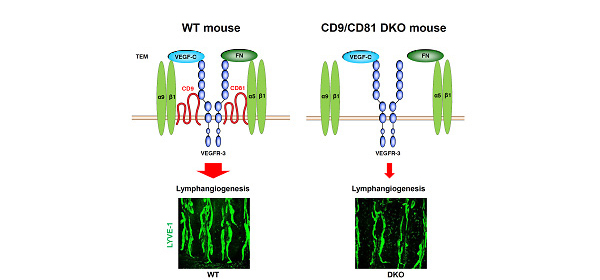 |
(8)エクソソームとテトラスパニン
免疫細胞や腫瘍細胞をはじめ、体内のあらゆる細胞から分泌されるエクソソーム(Exosome)と呼ばれる細胞外小胞が注目を集めている。脂質二重膜で包まれるエクソソームは、タンパク、核酸や脂質を内包し、ドナー細胞からレシピエント細胞へと細胞間や臓器間を移動する新規メッセンジャー(コミュニケーション手段)として機能しています。さらに、その内容物である蛋白や核酸が標的細胞へ受け渡されて機能することから、生理的状態だけでなく悪性疾患、免疫疾患、神経疾患から感染症に至るまで多くの疾患における病態や治療への可能性が脚光を浴びています。
近年、CD9やCD63などのテトラスパニンは、「エクソソーム・マーカー」として注目されています。しかし、テトラスパニンが、細胞膜の恒常性を維持する『分子オーガナイザー』であり、種々の炎症性疾患や悪性疾患における病態や治療に重要であることや私たちの知見から、エクソソームの単なる「マーカー」でないことは容易に想像されます。私たちの研究室では、テトラスパニンの『窓』からエクソソームの研究にも取り組んでいます。
遺伝子(宿主の要因)、環境や生活習慣など複雑な要因が絡み合って発症する炎症性呼吸器疾患は、癌におけるゲノム研究とは異なるアプローチが必要で、網羅的解析(オミクス)の重要性が注目されています。例えば、疾患の目印となるバイオマーカーも、癌においては癌細胞の遺伝子解析から候補となる薬剤を選択することも可能ですが、炎症性肺疾患においてはそのようなアプローチが困難です。一方、日常臨床で容易に使える血清・血漿には限界があり、プロテオミクスにおいては99%の血清夾雑物が、鍵分子を同定するのに大きなハードルとなっています。そこで、理想的なLiquid Biopsyと考えられる血清エクソソームと次世代プロテオミクスに注目した研究を展開しています。
超遠心法により単離した血清エクソソームについて、最新プロテオミクスを駆使したアプローチからマウスとヒトに共通した世界初のCOPD(肺気腫)バイオマーカー:Fibulin-3を同定しました。肺の弾性線維の構成成分であるフィブリン-3は、一秒量低下や肺気腫(CT)の広がりと相関するだけでなく、COPD病変部において発現増加を示しました。今まで呼吸器疾患におけるFibulin-3の役割が不明であることから、遺伝子欠損マウスを作成すると、無刺激で加齢とともに肺気腫(COPD)を発症しました(21)。世界死亡原因の第3位とされるCOPDにおいて、未だに有望なバイオマーカーが同定されていませんでしたが、私たちのアプローチから病態と密接に関わる新規BMが同定されました、今後は、診断薬として臨床応用の可能性を検討するとともに、Fibulin-3のCOPD発症における病態解明や新規治療薬の可能性について検討を進めていく予定です。同時に、このアプローチから、炎症性肺疾患や難病の新規BM開発だけでなく、病態解明や新規治療法開発に取り組んでいます。
(http://www.imed3.med.osaka-u.ac.jp/research/r-resp08.html)
(http://www.imed3.med.osaka-u.ac.jp/research/r-resp09.html)
(図11)エクソソーム(テトラスパニンが鍵分子)によるCOPDの新規BM同定
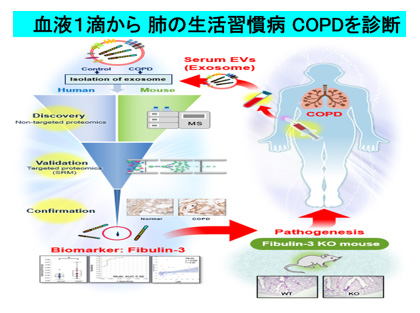 |
(9)肺線維症と肺気腫モデルによる気腫/線維化の病態解明
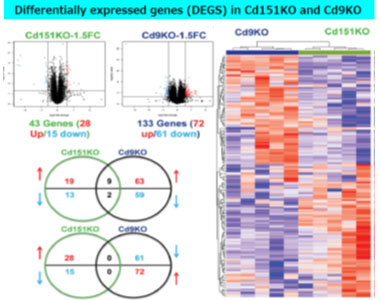
CD9/CD81二重欠損マウスは、肺胞破壊を伴うCOPD様表現型から、加齢とともに骨粗鬆症や筋肉萎縮を示す新規老化モデルとなる(19)。一方、CD9やCD81と分布や機能の異なるテトラスパニンCD151 欠損マウスは、加齢とともに無刺激で肺線維症を発症する。同じテトラスパニンでありながら、局在やパートナーの異なるテトラスパニンの発現低下が、肺気腫と肺線維症の病態を形成することから、気腫化と線維化を制御するメカニズムについて、マウス肺DNA マイクロアレイの比較解析から線維化と肺気腫に共通する分子を新たに見出した。
肺気腫感受性のCD9 KOマウスと、肺線維症になるCD151 KOマウスにおける遺伝子発現の差異を比較すると、共通して増加する遺伝子が71種類、減少する遺伝子が128種類認めた。さらにCD9 KOマウスとCD151 KOマウスで逆方向に動く10遺伝子を同定した(20)。これら共通・相違遺伝子の探索は、肺気腫や肺線維症だけでなく、肺気腫合併線維症の病態解明にも寄与すると考えられる。
| (図12)肺気腫と肺線維症の独自モデルによるバイオインフォマティクスによる病態解明 |
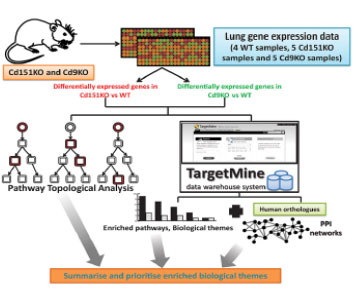 |
 |
研究業績
英文
- Tachibana I, Bodorova J, Berditchevski F, Zutter MM, Hemler ME. NAG-2, a novel transmembrane-4 superfamily (TM4SF) protein that complexes with integrins and other TM4SF proteins. J Biol Chem. 1997 Nov 14;272(46):29181-9.
- Tachibana I, Hemler ME. Role of transmembrane 4 superfamily (TM4SF) proteins CD9 and CD81 in muscle cell fusion and myotube maintenance. J Cell Biol. 1999 Aug 23;146(4):893-904.
- Funakoshi T, Tachibana I, Takeda Y, Kijima T, Nishino K, Goto H, Yoneda T, Kumagai T, Osaki T, Hayashi S, Aozasa K, Kawase I. Expression of tetraspanins in human lung cancer cells: frequent downregulation of CD9 and its contribution to cell motility in small cell lung cancer. Oncogene. 2003 Feb 6;22(5):674-87.
- Takeda Y, Tachibana I, Miyado K, Kobayashi M, Miyazaki T, Funakoshi T, Kimura H, Yamane H, Saito Y, Goto H, Yoneda T, Yoshida M, Kumagai T, Osaki T, Hayashi S, Kawase I, Mekada E. Tetraspanins CD9 and CD81 function to prevent the fusion of mononuclear phagocytes. J Cell Biol. 2003 Jun 9;161(5):945-56.
- Yamane H, Tachibana I, Takeda Y, Saito Y, Tamura Y, He P, Suzuki M, Shima Y, Yoneda T, Hoshino S, Inoue K, Kijima T, Yoshida M, Kumagai T, Osaki T, Eishi Y, Kawase I. Propionibacterium acnes-induced hepatic granuloma formation is impaired in mice lacking tetraspanin CD9. J Pathol. 2005 Aug;206(4):486-92.
- Saito Y, Tachibana I, Takeda Y, Yamane H, He P, Suzuki M, Minami S, Kijima T, Yoshida M, Kumagai T, Osaki T, Kawase I. Absence of CD9 Enhances Adhesion-Dependent Morphologic Differentiation, Survival, and Matrix Metalloproteinase-2 Production in Small Cell Lung Cancer Cells. Cancer Res. 2006 Oct 1;66(19):9557-65.
- Takeda Y, Kazarov AR, Butterfield CE, Hopkins BD, Benjamin LE, Kaipainen A, Hemler ME. Deletion of tetraspanin Cd151 results in decreased pathologic angiogenesis in vivo and in vitro. Blood. 2007 Feb 15;109(4):1524-32.
- Takeda Y, Ping He, Tachibana I, Miyado K, Kaneko H, Suzuki M, Minami S, Iwasaki T, Goya S, Kijima T, Kumagai T, Yoshida M, Osaki T, Kitaoka H, Komori T, Mekada E, and Kawase I. Double deficiency of tetraspanins CD9 and CD81 alters cell motility and protease production of macrophages and causes chronic obstructive pulmonary disease-like phenotype in mice. J Biol Chem. 2008 Sep 19;283(38):26089-97.
- Mayumi Suzuki, Isao Tachibana, Yoshito Takeda, Ping He, Seigo Minami, Takeo Iwasaki, Sho Goya, Takashi Kijima, Toru Kumagai, Mitsuhiro Yoshida, Tadashi Osaki, and Ichiro Kawase. Tetraspanin CD9 negatively regulates lipopolysaccharide-induced macrophage activation and lung inflammation. J Immunol 2009 May 15;182(10):6485-93.
- Kohmo S, Kijima T, Otani Y, Mori M, Minami T, Takahashi R, Nagatomo I, Takeda Y, Kida H, Goya S, Yoshida M, Kumagai T, Tachibana I, Yokota S, Kawase I. Cell surface tetraspanin CD9 mediates chemoresistance in small cell lung cancer. Cancer Res. 2010 Oct 15;70(20):8025-35.
- Takeda Y, Li Q, Kazarov AR, Epardaud M, Elpek K, Turley SJ, Hemler ME. Diminished metastasis in tetraspanin CD151 knockout mice. Blood. 2011 Jul 14;118(2):464-72.
- Tsujino K, Takeda Y, Arai T, Shintani Y, Inagaki R, Saiga H, Iwasaki T, Tetsumoto S, Jin Y, Ihara S, Minami T, Suzuki M, Nagatomo I, Inoue K, Kida H, Kijima T, Ito M, Kitaichi M, Inoue Y, Tachibana I, Takeda K, Okumura M, Hemler ME, Kumanogoh A. Tetraspanin CD151 Protects against Pulmonary Fibrosis by Maintaining Epithelial Integrity. Am J Respir Crit Care Med. 2012 Jul 15;186(2):170-80.
- Iwasaki T, Takeda Y, Maruyama K, Yokosaki Y, Tsujino K, Tetsumoto S, Kuhara H, Nakanishi K, Otani Y, Jin Y, Kohmo S, Hirata H, Takahashi R, Suzuki M, Inoue K, Nagatomo I, Goya S, Kijima T, Kumagai T, Tachibana I, Kawase I, Kumanogoh A. Deletion of tetraspanin CD9 diminishes lymphangiogenesis in vivo and in vitro. J Biol Chem. 2013 Jan 25;288(4):2118-31.
- He P, Kuhara H, Tachibana I, Jin Y, Takeda Y, Tetsumoto S, Minami T, Kohmo S, Hirata H, Takahashi R, Inoue K, Nagatomo I, Kida H, Kijima T, Naka T, Morii E, Kawase I, Kumanogoh A. Calretinin mediates apoptosis in small cell lung cancer cells expressing tetraspanin CD9. FEBS Open Bio. 2013 May 10;3:225-30.
- Turner AM, McGowan L, Millen A, Rajesh P, Webster C, Langman G, Rock G, Tachibana I, Tomlinson MG, Berditchevski F, Naidu B. Circulating DBP level and prognosis in operated lung cancer: an exploration of pathophysiology. Eur Respir J. 2013 Feb;41(2):410-6.
- Jin Y, Tachibana I, Takeda Y et al. Statins decrease lung inflammation by upregulating macrophage tetraspanin CD9 in mice. PLoS One. 2013 Sep 9;8(9):e73706.
- Sun J, Wang J, Pefanis E, Chao J, Rothschild G, Tachibana I, Chen JK, Ivanov II, Rabadan R, Takeda Y, Basu U. Transcriptomics Identify CD9 as a marker of murine IL-10-competent regulatory B cells. Cell Rep. 2015 Nov 10;13(6):1110-7.
- Takeda Y, Suzuki M, Jin Y, Tachibana I. Preventive Role of Tetraspanin CD9 in Systemic Inflammation of Chronic Obstructive Pulmonary Disease. Am J Respir Cell Mol Biol. 2015 Dec;53(6):751-60.
- Jin Y, Takeda Y, Kondo Y, Tripathi LP, Kang S, Takeshita H, Kuhara H, Maeda Y, Higashiguchi M, Miyake K, Morimura O, Koba T, Hayama Y, Koyama S, Nakanishi K, Iwasaki T, Tetsumoto S, Tsujino K, Kuroyama M, Iwahori K, Hirata H, Takimoto T, Suzuki M, Nagatomo I, Sugimoto K, Fujii Y, Kida H, Mizuguchi K, Ito M, Kijima T, Rakugi H, Mekada E, Tachibana I, Kumanogoh A. Double deletion of tetraspanins CD9 and CD81 in mice leads to a syndrome resembling accelerated aging. Sci Rep. 2018 Mar 23;8(1):5145.
- Integrative analysis reveals common and unique roles of tetraspanins in fibrosis and emphysema. Lokesh Pati Tripathi, Mari N. Itoh, Yoshito Takeda, Kazuyuki Tsujino, Yasushi Kondo, Atsushi Kumanogoh, Kenji Mizuguchi. Frontiers in Genet. 2020 Dec 10;11:585998.
- Proteomics of serum extracellular vesicles identifies a novel COPD biomarker, fibulin-3 from elastic fibres. Koba, Taro; Takeda, Yoshito; Narumi, Ryohei; Shiromizu et al. ERJ Open Res. 2021 Mar 22;7(1):00658-2020.
- CD9-positive cells in the intermediate lobe of the pituitary gland are important supplier for prolactin-producing cells in the anterior lobe. Horiguchi K, Fujiwara K, Takeda Y, Nakakura T, Tsukada T, Yoshida S, Hasegawa R, Takigami S, Ohsako S. Cell Tissue Res. 2021 May 7. doi: 10.1007/s00441-021-03460-5.
- Next-generation proteomics of serum extracellular vesicles combined with single-cell RNA sequencing identifies MACROH2A1 associated with refractory COVID-19. Kawasaki T, Takeda Y, Edahiro R, Shirai Y, Nogami-Itoh M, Matsuki T, Kida H, Enomoto T, Hara R, Noda Y, Adachi Y, Niitsu T, Amiya S, Yamaguchi Y, Murakami T, Kato Y, Morita T, Yoshimura H, Yamamoto M, Nakatsubo D, Miyake K, Shiroyama T, Hirata H, Adachi J, Okada Y, Kumanogoh A. Inflamm Regen. 2022 Nov 30;42(1):53.
- SFTPB in serum extracellular vesicles as a biomarker of progressive pulmonary fibrosis. Enomoto T, Shirai Y, Takeda Y, Edahiro R, Shichino S, Nakayama M, Takahashi-Itoh M, Noda Y, Adachi Y, Kawasaki T, Koba T, Futami Y, Yaga M, Hosono Y, Yoshimura H, Amiya S, Hara R, Yamamoto M, Nakatsubo D, Suga Y, Naito M, Masuhiro K, Hirata H, Iwahori K, Nagatomo I, Miyake K, Koyama S, Fukushima K, Shiroyama T, Naito Y, Futami S, Natsume-Kitatani Y, Nojima S, Yanagawa M, Shintani Y, Nogami-Itoh M, Mizuguchi K, Adachi J, Tomonaga T, Inoue Y, Kumanogoh A. JCI Insight. 2024 Jun 10;9(11):e177937.
- Galectin-10 in serum extracellular vesicles reflects asthma pathophysiology. Yoshimura H, Takeda Y, Shirai Y, Yamamoto M, Nakatsubo D, Amiya S, Enomoto T, Hara R, Adachi Y, Edahiro R, Yaga M, Masuhiro K, Koba T, Itoh-Takahashi M, Nakayama M, Takata S, Hosono Y, Obata S, Nishide M, Hata A, Yanagawa M, Namba S, Iwata M, Hamano M, Hirata H, Koyama S, Iwahori K, Nagatomo I, Suga Y, Miyake K, Shiroyama T, Fukushima K, Futami S, Naito Y, Kawasaki T, Mizuguchi K, Kawashima Y, Yamanishi Y, Adachi J, Nogami-Itoh M, Ueki S, Kumanogoh A. J Allergy Clin Immunol. 2024 May;153(5):1268-1281.
- Proteomics of blood extracellular vesicles in inflammatory respiratory diseases for biomarker discovery and new insights into pathophysiology. Kawasaki T, Takeda Y, Kumanogoh A. Inflamm Regen. 2024 Sep 18;44(1):38.
和文
- 立花 功、船越俊幹、川瀬一郎 肺癌と転移抑制因子テトラスパニン The LUNG perspective, メディカルレビュー社 vol.11 No.3, 354-361, 2003
- 武田吉人、立花 功、川瀬一郎 COPDモデルとしてのテトラスパニンCD9/CD81ダブルノックアウトマウスの解析 International Review of Asthma & COPD vol.11, No.4, 31-36, 2009
- 立花 功 分子オーガナイザ CD9 と CD81 ダブルノックアウトマウスにおける肺気腫と骨量減少 呼吸 29:194-210, 2010.
- 武田吉人、鈴木真優美、立花 功 COPDにおけるテトラスパニンの役割 The LUNG perspective, メディカルレビュー社 vol.18 No.3, 291-298, 2010
- 立花 功、鈴木真優美、武田吉人、山根宏之、和 平、川瀬一郎 マクロファージの活性化におけるCD9 (tetraspanin)の関与 臨床免疫・アレルギー科、53 (2):214-220, 2010
- 立花 功、武田吉人、鈴木真優美、川瀬一郎 テトラスパニン CD9 と COPD The LUNG perspective, メディカルレビュー社 vol.19 No.2, 188-193, 2011
- 武田吉人、立花 功、熊ノ郷 淳 慢性閉塞性肺疾患と老化 内分泌・糖尿病・代謝内科 Vol.37, No2, 2013
- 武田吉人、立花 功、熊ノ郷 淳 テトラスパニンによる肺気腫と肺線維症の病態解明.分子呼吸器病学 Vol.18 No1 2014
- 鉄本訓史、武田吉人、木島貴志、立花 功、熊ノ郷 淳 呼吸器疾患と動物モデル 呼吸器学会雑誌 3(5): 630-635, 2014.
- 武田吉人 分子オーガナイザー:テトラスパニンからみた呼吸器疾患(肺気腫、肺線維症から老化まで). 呼吸. Vol34, No1. 92-98, 2015
- 武田吉人 呼吸器疾患における新規メッセンジャー:エクソソーム. 分子呼吸器病学 2015
- 玄山宗到、平田陽彦、武田吉人 COPDにおける慢性炎症 呼吸と循環 Vol64, No2,137-143, 2016
- 玄山宗到、武田吉人 COPDと慢性炎症 最新医学.2016;71(11)
- 矢賀元、木庭太郎、武田吉人 プロテオミクスがひもとく炎症性呼吸器疾患 最新医学 2019年2月:233-239
- 木庭太郎、武田吉人 雑誌名:Medical Practice 2018年8月 ページ: 1215 -1219
- 武田吉人 岡本肺線維症研究基金 記念誌 27年のあゆみ p40
- 木庭太郎、武田吉人、熊ノ郷 淳 21世紀の国民病COPD:慢性閉塞性肺疾患 最新医学 2018, 10, 8-94, 南山堂 免疫・炎症病態 X 治療
- 白井雄也、木庭太郎、武田吉人 血清エクソソームの最新定量プロテオミクスを用いた線維化マーカーの探索 分子呼吸器病 24(1): 71-77 2020
- 原 伶奈, 武田吉人 間質性肺炎のバイオマーカー 呼吸器内科, 2022年42 (6) 658-666
- 吉村華子、武田吉人 喘息における細胞外小胞の有用性 呼吸器内科 2024年第45巻第4号、416-421
- 武田吉人 サルコイドーシスにおける肉芽腫形成・線維化機序解明 日本サルコイドーシス/肉芽腫性疾患学会雑誌 45 (1/2) 3-9, 2025.
特許
| # |
CD9/CD81二重欠損非ヒト動物 :【特許】WO2004108924A1 |
| # |
炎症バイオマーカー:特願 2017-48161
発明者:武田吉人、熊ノ郷 淳、葉山善友、特許登録日 2017年3月14日 |
| # |
閉塞性肺疾患バイオマーカー:特願 2017-48164(PCT/JP2018/009502)
発明者:武田吉人、熊ノ郷 淳、玄山宗到、植田幸嗣、特許登録日 2017年3月14日 |
| # |
組織線維化バイオマーカー:特願 2017-48167(PCT/JP2018/009503)
発明者:武田吉人、熊ノ郷 淳、松木 隆典、植田幸嗣、特許登録日 2017年3月14日 |
| # |
慢性閉塞性肺疾患バイオマーカー:特願 2017-48171(PCT/JP2018/009529)
発明者:武田吉人、熊ノ郷 淳、木庭太郎、特許登録日 2017年3月14日 |
| # |
老化バイオマーカー:特願 2017-48173
発明者:武田吉人、熊ノ郷 淳、植田幸嗣、特許登録日 2017年3月14日 |
| # |
リンパ脈管筋腫症バイオマーカー:特願 2018-48266
発明者:滝本宜之、武田吉人、井上義一、熊ノ郷 淳 |
| # |
サルコイドーシス バイオマーカー:特願 2019-017978(PCT/JP2020/004074)
発明者:武田吉人、熊ノ郷 淳、木庭太郎、二見 悠、植田幸嗣 |
| # |
悪性胸膜中皮腫バイオマーカー:特願 2021-101842(K20200194)
発明者:武田吉人、熊ノ郷 淳、安部祐子 |
| # |
PF層別化マーカーのスクリーニング手法、IPF層別化マーカーおよび創薬標的:特願 K20210423 : 令和4年3月18日
発明者:武田吉人、熊ノ郷 淳 |
| # |
次世代プロテオミクスおよびシングルセル解析によるCOVID-19肺炎の新規重症化バイオマーカー:特願 2022-167186
発明者:川﨑貴裕、武田吉人、熊ノ郷 淳 |
報道
- 武田・立花の論文が日刊工業新聞に掲載されました。(詳細はこちら)
- 辻野・武田の論文がBlue journalに掲載され、全国主要各紙に掲載されました。(詳細はこちら)
- 金・武田のアンチエイジングに関する研究成果が、日経・読売新聞に掲載されました(2013年12月)。(詳細はこちら)
- 金・武田のCOPDと老化に関する研究成果が、読売新聞に掲載されました。(詳細はこちら)
- 木庭・武田のCOPDにおける新規BM同定の論文が、日本経済新聞に掲載されました。(詳細はこちら)
- 『細胞の情報伝えるEVに注目 血・尿から分離、がんの発見や再生医療に』朝日新聞(2023.2.17).
海外学会報告
- 2002 FASEB meeting (invited speaker)
- 2004 FASEB meeting (invited speaker)
- 2006 AACR (postar presentation)
- 2008 FASEB meeting (oral presentation)
- 2010 4th European Conference on Tetraspanins (oral presentation)
- 2011 ATS (postar presentation)
- 2011 FASEB meeting (invited speaker)
- 2012 5th European Conference on Tetraspanins (oral presentation)
- 2012 ATS (postar discussion)
- 2012 Keystone Symposia (oral presentation)
- 2013 ATS (postar presentation)
- 2014 ATS (postar discussion)
- 2016 ATS (postar presentation)
- 2017 Keystone Symposia (postar presentation)
- 2018 ATS (postar presentation)
- 2019 ATS (postar presentation)
- 2019 WASOG (postar presentation)
- 2020 ATS (postar presentation, oral presentation)
- 2020 ISEV (postar presentation)
- 2021 ATS(postar presentation)
- 2022 ATS(postar presentation)
- 2023 ISEV (postar presentation)
- 2024 ISEV (postar presentation)
受賞
- 第20回千葉保之・本間日臣記念賞(サルコイドーシス学会 学会賞)
- Pneumo Forum賞
- 平成23年度 アボットジャパン・アレルギー学術奨励賞
- 第55回 日本老年医学会総会 最優秀演題賞
- 第55回 日本呼吸器学会 熊谷賞(学会賞)(詳細はこちら)
- 第54回 呼吸器学会総会 International Session Award
- アレルギー協会 真鍋学術奨励賞
- 第5回抗加齢研究奨励賞
- 上原記念生命科学財団 研究助成
- 岡本記念肺線維症研究基金
- 加藤記念難病研究財団
- 武田科学振興財団医学系研究奨励
スタッフ
| 武田 吉人 |
准教授 |
| 榎本 貴俊 |
大学院生 |
| 吉村 華子 |
技術補佐員 |
| 中山 真奈 |
技術補佐員 |
共同研究募集
 テトラスパニンはインテグリンのキーパートナーとして呼吸器疾患だけでなく、様々な疾患において創薬の標的にもなりうるユニークなタンパクファミリーです。最近、エクソソームの『目印『や『鍵分子』としての注目が高まっています。大学院生として学位(博士号)を取得することも可能です。一緒に研究して下さる方、共同研究を考えておられる方や興味を持たれた方は、下記までご連絡をお待ちしています。
テトラスパニンはインテグリンのキーパートナーとして呼吸器疾患だけでなく、様々な疾患において創薬の標的にもなりうるユニークなタンパクファミリーです。最近、エクソソームの『目印『や『鍵分子』としての注目が高まっています。大学院生として学位(博士号)を取得することも可能です。一緒に研究して下さる方、共同研究を考えておられる方や興味を持たれた方は、下記までご連絡をお待ちしています。
連絡先
大阪大学大学院医学系研究科 呼吸器・免疫内科
呼吸器内科
科長 武田 吉人
Tel: 06-6879-3833
Fax: 06-6879-3839
yoshito@imed3.med.osaka-u.ac.jp













 テトラスパニンはインテグリンのキーパートナーとして呼吸器疾患だけでなく、様々な疾患において創薬の標的にもなりうるユニークなタンパクファミリーです。最近、エクソソームの『目印『や『鍵分子』としての注目が高まっています。大学院生として学位(博士号)を取得することも可能です。一緒に研究して下さる方、共同研究を考えておられる方や興味を持たれた方は、下記までご連絡をお待ちしています。
テトラスパニンはインテグリンのキーパートナーとして呼吸器疾患だけでなく、様々な疾患において創薬の標的にもなりうるユニークなタンパクファミリーです。最近、エクソソームの『目印『や『鍵分子』としての注目が高まっています。大学院生として学位(博士号)を取得することも可能です。一緒に研究して下さる方、共同研究を考えておられる方や興味を持たれた方は、下記までご連絡をお待ちしています。