大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
全身性強皮症は疾患の特徴である皮膚硬化以外にも、レイノー症状、指尖潰瘍、肺動脈性肺高血圧症、強皮症腎クリーゼ、消化管障害、間質性肺炎など様々な病態を呈する疾患で、それぞれの病態に即して薬物を選択する。
レイノー症状には経口ニフェジピン、指尖潰瘍に至るようであればPDE5阻害剤やボセンタンを使用する。保温などの物理的治療も直接的で有益。
肺動脈性肺高血圧症は労作時呼吸困難から始まり、呼吸機能検査(%DLCO低下)、心電図(右軸編位)、心エコーや右心カテーテル検査で診断する。血管拡張作用を有するPDE5阻害剤(タダラフィル)とエンドセリン受容体拮抗薬(アンブリセンタン)併用が第一選択とされ、プロスタサイクリン類似体(セレキシパグ)や重症ではエポプロステノール静脈投与を検討する。
強皮症腎では短期間で血中レニン・アルドステロンの濃度上昇と血圧上昇による腎障害進展といった悪循環が発生するためACE阻害薬を直ちに開始、高用量を必要とすることもある。
逆流性食道炎にはPPI、消化管運動障害にはドンペリドンなどの運動促進薬が経験的に用いられる。
皮膚硬化に対してはMTX、MMF、RTXなどを使用するが効果は限定的なことが多い。CRP=0.6以上の炎症がある場合はTCZで改善傾向がある。
間質性肺炎は胸部HRCTで病変の広がり、呼吸機能検査で%FVCや%DLCO低下、血液検査でKL-6、SP-Dなどをモニターして進行が予測される場合、MMF、シクロホスファミド、RTX、TCZなどの免疫抑制剤と繊維化抑制剤のニンテダニブを使用する。しかし呼吸機能の進行性低下を緩やかにするくらいのデータが多い。
全身性強皮症の各種病態に対する薬物効果は不十分な事が多く、新薬の臨床試験やCAR-T細胞療法などの新しい治療が試みられている。
全身性強皮症では、レイノー現象や指尖潰瘍など血行不良を伴う症状があり、血流保持のために寒冷暴露を避けるよう指導する。日本では、冬期の部屋単位での暖房が行われるため各部屋、廊下、脱衣所などの温度差に留意し、買い物時に冷蔵冷凍食品類をなるべく素手で持たないなど指導が必要である。夏季は冷房の強く効いている場所へは寄らない。
手足などの末梢の血流不全には各種の懐炉(肘に巻く桐灰ヒエナース、桐灰巻きポカ足首用や手首用)、ヒーター手袋、外出時にはマフ(筒状に編まれた防寒具)の中にカイロを入れるなど、外部から暖める必要がある。指先などの傷は血流が悪く治りが悪いため、特に低温火傷しないよう気を付ける。
皮膚硬化から関節拘縮をきたす事があり、ストレッチを基本とするリハビリで手指の可動域を保つことも推奨されている。
(強皮症・皮膚線維化疾患の診断基準・重症度分類・診療ガイドライン・疾患レジストリに関する研究班編集、日本小児リウマチ学会、日本皮膚科学会、日本リウマチ学会協力)金原出版
以下に全体をまとめたが、詳細はガイドライン原本、または、厚生労働科学研究成果(資料4) 全身性強皮症診療ガイドライン (2023 年版〔予定〕) をご参照ください。
括弧内は順に、推奨度(強い推奨1は赤字、弱い推奨2、しないことを弱く推奨3、しないことを強く推奨4)、エビデンスレベル(強い確信Aと中程度の確信Bは赤字、限定的な確信C、殆ど確信できないD)、合意度
| 皮膚硬化 |
|---|
| 皮膚硬化では手指屈曲障害(拘縮)、伸展障害、下肢つっぱり感、手足の皮膚乾燥・角化、前腕の多毛、仮面様顔貌、開口障害、口囲の皺、顎部の陥凹、胸郭拡張障害による息切れなどがみられる。 |
| palmar fasciitis and polyarthritis syndrome、RS3PE、Wells症候群、指趾炎、強皮骨膜症、晩発性皮膚ポルフィリン症、generalized morphea、好酸球性筋膜炎、Werner症候群、POEMS症候群、scleromyxoedema、成年性浮腫性硬化症、nephrogenic systemic fibrosis、糖尿病による皮膚硬化、慢性移植片対宿主病、ヒトアジュバント病、化学物質や薬剤による皮膚硬化、レイノー現象を呈する疾患などとの鑑別を要す。 |
| 皮膚硬化の半定量的評価にmRSSが有用(1 B 8.5)。急速(数ヶ月〜1年)な皮膚硬化進行を認め、皮膚硬化出現から6年以内、又は浮腫性硬化が主な例が全身療法の積極的適応(2 D 8.1)。 |
| 皮膚硬化にRTX(1 A 8.4)、シクロフォスファミド(2 A 8.2)、MMF(2 B 8.3)、MTX(2 C 8.3)、タクロリムス(2 C 8.0)、シクロスポリン(2 D 8.0)、アザチオプリン(2 D 7.7)、紫外線療法(2 C 7.7)、発症早期進行例でグルココルチコイド(GC)内服(2 C 8.1)など有用性で提案。トシリズマブ(TCZ)(2 D 8.3)は皮膚硬化に改善傾向あるが慎重に考慮。造血幹細胞移植は有効性が示されているが安全性から適応は慎重に選択(2 A 8.5)。 |
| 外用薬、D-ペニシラミン、IVIG、イマチニブ、ミノサイクリン、トラニラスト、ボセンタン、シルデナフィル、ニンテダニブ、血漿交換療法は有効性が明らかでない。 |
| 血管病変 |
| 血管病変は若年発症、広範な皮膚硬化、抗トポイソメラーゼI抗体陽性で現れやすく(2 C 8.6)、喫煙、寒冷、精神的ストレス、急激な環境温度変化を避け、手指や体幹を保温する(1 C 8.8)。 |
| レイノー現象に対してCa拮抗薬(1 A 8.6)、抗血小板薬、ベラプロストナトリウム、塩酸サルポグレラート、アルプロスタジルが有用性で推奨(1 C 8.7)。 |
| 血管病変にACE阻害薬、ARBは有用性が明らかでない。 |
| 皮膚石灰沈着に対して、ワルファリン(2 C 7.9)、塩酸ジルチアゼム、ミノサイクリン、コルヒチン、ビスフォスフォネート、チオ硫酸ナトリウム、グルココルチコイド、RTXなど(2 D 7.8)、が報告されており、選択肢の一つとして提案。 |
| 外科的摘出や炭酸ガスレーザー、体外衝撃波治療は疼痛緩和・関節可動域制限の改善に有用であると考えられ、選択肢の一つとして提案(2 D 8.1)。 |
| 指尖潰瘍 |
| 指尖潰瘍に対する有用性で塩酸サルボグレラート、アルプロスタジルを推奨(1 C 8.7)。潰瘍治療に抗トロンビン薬を推奨(1 C 8.5)。潰瘍予防にボセンタンを推奨(1 A 8.8)、アンブリセンタンは使用を慎重に考慮(2 C 8.3)、マシテンタンは潰瘍縮小に期待できる(2 C 8.3)。 |
| ホスホジエステラーゼ5阻害薬のシルデナフィルとタダラフィルはレイノー現象と指尖潰瘍の治療に推奨(2 A 8.5)、他にパルデナフィル(2 C 8.3)、リオシグアト(2 C 8.2)、高圧酸素療法(2 D 8.3)、オゾン療法は選択肢(2 B 8.6)。 |
| 手術療法は分層植皮術(1 D 8.3)を推奨、他に交感神経切除術(2 D 8.2)、交感神経ブロック(2 D 8.0)、ボツリヌス毒素(2 B 8.3)、スタチン(2 B 8.2)は選択肢。安易な切断術はしない(4 D 8.6)。 |
| 外用薬はトラフェルミン、プロスタグランジンE1軟膏、白糖・ポピドンヨード配合軟膏、ブクラデシンナトリウム軟膏が有用性で推奨(1 D 8.6)。他にフルオロキセチンや硝酸グリセリン貼付(2 B 8.3)、陰圧閉鎖療法、間歇的空気圧迫治療、濃厚血小板血漿、血管新生療法の報告もある(2 D 8.2)。 |
| 間質性肺疾患(ILD) |
| ILDは全患者HRCTでスクリーニング(1 C 8.8)、自覚症状、呼吸機能検査、胸部画像を組み合わせて評価(1 B 8.8)。FVC低下の予測因子は、びまん皮膚硬化型、短い罹病期間、1年以内で皮膚硬化進行例、mRSS高値、男性、胃食道逆流症状、抗トポイソメラーゼI抗体、KL-6高値(1273U/ml以上)、CRPや血小板増加など。 |
| 第一選択薬はシクロフォスファミド、MMF、TCZ、RTX、ニンテダニブのいずれか単剤使用を推奨(1 A 8.7)。それでも進行なら未使用薬への変更や追加併用、自家末梢血造血幹細胞移植、肺移植登録を提案(2 C 8.6)。 |
| 消化管 |
| 胃食道逆流症の症状にPPIやボノプラザンを推奨(1 B 8.8)、生活習慣の改善(2 C 8.8)を提案、手術療法(2 D 7.7)は選択肢。逆流性食道炎や腹部膨満など上部消化管蠕動運動低下に対して胃腸機能調整薬(2 B 8.4)、六君子湯(2 D 7.9)、上部消化管通過障害にバルーン拡張術は選択肢(2 D 8.1)。空腸以降の蠕動が良好なら空腸栄養チューブの経管栄養は選択肢(2 D 8.3)。 |
| 小腸内細菌異常増殖症(SIBO)に抗菌薬(シプロフロキサシン、メトロニダゾールなど)を間欠的あるいは順次変更投与(1 C 8.5)。 |
| 腸の蠕動運動低下に、食事療法(2 D 8.5)、消化管機能調整薬(ドンペリドン、メトクロプラミド、モサプリド)(2 C 8.5)、オクトレオチド(2 B 8.0)、大建中湯(2 D 8.0)、パントテン酸(2 D 7.9)、酸素療法(2 D 8.0)、副交感神経作用薬(2 D 7.9)、エロビキシバット(2 D 8.0)、ポリエチレングリコール(2 D 8.1)、ラクツロース(2 D 8.1)、リナクロチド(2 D 8.1)、ルビプロストン(2 D 8.1)など提案。 |
| 腸管嚢腫様気腫症に酸素療法(2 D 8.0)は選択肢。重篤な下部消化管病変による通過障害に対し限られた場合を除き手術療法はしない(3 D 8.5)。中心静脈栄養は選択肢(2 D 8.5)。 |
| 胃前庭部毛細血管拡張症(GAVE)に対して内視鏡治療は選択肢(2 D 8.6)。 |
| 強皮症腎クリーゼ |
| 腎障害は腎クリーゼ以外に、ANCAを伴う糸球体腎炎、薬剤性腎障害を鑑別(1 B 8.8)、腎クリーゼ予測因子は抗RNAポリメラーゼIII抗体、尿蛋白出現、新規高血圧、新規心膜炎を考慮(1 B 8.8)。 |
| 腎クリーゼに予防薬はない(3 B 8.8)。GC(1 A 8.8)はリスク因子、投与時は腎機能と血圧をモニターする。カルシニューリン阻害薬(2 C 8.5)もリスクの可能性がある。 |
| 重症度は治療開始時Cr、eGFRで評価、重症度分類は血清シスタチンeGFRを用いる(1 A 8.8)。 |
| 腎クリーゼの第一選択薬はACE阻害剤(カプトプリル、エナラプリル、4〜8時間毎に増量し、72時間以内に収縮期血圧140mmHg以下にする)(1 A 9.0)で、ARBは第一選択薬とはしない(3 A 8.7)が、ACE阻害剤単独で降圧効果が得られなければCa拮抗薬やARBを併用、TMAを合併する場合は血漿交換を行う(2 B 8.3)。急速に腎不全に至ることがあり血液透析管理を行う(1 A 8.8)。透析管理患者では腎移植も選択肢の一つ(2 B 8.2)。 |
| 心臓病変 |
| SScの心臓病変は拡張障害が最多で、SScの約20%で認めるためスクリーニングを行う(1 C 8.8)。収縮障害、冠動脈疾患、伝導障害、心外膜炎、弁膜症(A弁、M弁)なども検索(1 C 8.7)。 |
| 心筋障害のスクリーニング、重症度評価は血清BNPやNT-proBNPを測定し(2 C 8.7)、心臓病変の検出に心エコー(1 C 8.8)を推奨、心臓MRI(2 C 8.3)、心筋シンチ(2 C 8.3)を提案。 |
| 心臓病変にCa拮抗薬、ACE阻害薬、ARBは選択肢だが、他に特異的な治療法なく、原因疾患に応じた治療を提案(2 C 8.6)。心臓病変への免疫抑制療法の有用性は明らかでない。 |
| 肺高血圧症(PH) |
| PHには肺動脈性肺高血圧症(PAH)、左心疾患PH(PVH)、間質性肺疾患PH(ILD-PH)があり10:10:2.5-3程度。PAHのリスク因子は限局皮膚硬化型、毛細血管拡張、抗セントロメア抗体、抗U1-RNP抗体があり、全SSc患者は年一回定期スクリーニングを推奨(1 C 8.7)。スクリーニングは身体所見(毛細血管拡張)、BNP、NT-proBNP、尿酸値、心電図(右軸偏位)、呼吸機能検査(%DLCO が55%未満、%FVC/%DLCOが1.6以上など)、心エコーが有用(1 C 8.8)。 |
| 男性、心係数、6分間歩行距離、BNP/NT-proBNPがPAHの予後規定因子(1 C 8.8)で、WHO機能分類、%DLCO、肺血管抵抗などが予後を規定する(2 C 8.6)。 |
| 心エコーにて三尖弁逆流速度(TRV)が3.4m/s超える(=TRPG>46mmHg)とPHの可能性が高く右心カテ実施(2 A 8.6)、3.4m/s以下では他にPH疑う所見あれば右心カテ実施(2 B 8.6)。 |
| 心筋内繊維化による両心室の拡張障害の検出に生食負荷試験は有用な可能性がある(2 C 8.4)。右心不全に対する利尿剤投与、Pa02=60mmHgを維持するため酸素療法を行い、運動療法も有用である可能性がある(2 C 8.6)。 |
| SLEやMCTDのPAHは免疫抑制剤で進行が抑制されることがあるが、SSc-PAHでは免疫抑制剤は効果なく推奨しない(3 C 8.3)。 |
| WHO機能分類I度 やPA圧境界域高値(21~24mmHg)に対してベラプロスト、セレキシパグ、アンブリセンタン、リオシグアト(2C 8.3)を提案 |
| WHO機能分類II度のSSc-PAHに対して、エンドセリン受容体拮抗薬(ERA)(ボセンタン、アンブリセンタン、マシテンタン)、ホスホジエステラーゼ(PDE)5阻害薬(シルデナフィル、タダラフィル)、可溶性グアニル酸シクラーゼ刺激薬(リオシグアト)、セレキシパグを推奨(1 B 8.7)。ベラプロストとその徐放剤を提案(2 C 8.6)、ERAとPDE5阻害薬の初期併用を提案(2 B 8.5)。 |
| WHO機能分類III度のSSc-PAHに対して、ERA(ボセンタン、アンブリセンタン、マシテンタン)、PDE5阻害薬(シルデナフィル、タダラフィル)、リオシグアト、セレキシパグ、エポプロステノール静注、トレプロスティニル皮下注、イロプロスト吸入を推奨(1 B 8.8)。ベラプロスト(2 C 8.6)、トレプロスティニル静注を提案(2 A 8.8)、これらの薬剤の初期併用療法を提案(2 A 8.8)。 |
| WHO機能分類IV度のSSc-PAHに対して、エポプロステノール静注を推奨(1 A 8.8)、ERA(ボセンタン、アンブリセンタン、マシテンタン)、PDE5阻害薬(シルデナフィル、タダラフィル)、リオシグアト、トレプロスティニル皮下注および静注、イロプロスト吸入、エポプロステノール静注を含む初期併用療法(2 A 8.7)、エポプロステノール静注以外の薬剤による初期併用療法を提案(2 C 8.5)。 |
| SSc-PAHの目標はWHO機能分類I/II度、6分歩行>440m、BNP<50ng/L又はNT-proBNP<300ng/mL、右心カテで右房圧<8mmHgおよび心係数≧2.5L/min/m2(1 C 8.7)。 |
| Group2のPH(3 C 8.3)やILD-PH(3 C 8.5)に対するPAH治療薬の使用は慎重に行う。難治性SSc-PAHやILDに肺移植の適応を評価する(2 B 8.6)。 |
| 骨関節 |
| 女性(閉経有無に関わらず)、びまん皮膚硬化型、GC使用は骨量減少の高リスクで定期的に骨密度評価(1 A 8.8)。 |
| 活性型Vit D(1 B 8.5)、Ca製剤(1 B 8.5)、ビスホスホネート(上部消化管運動障害では注意)(2 C 8.6)、PTH製剤(2 C 8.4)、抗RANKL抗体や抗スクレロスチン抗体を提案(2 C 8.4)。 |
| 関節症状として関節痛、関節炎、腱鞘滑膜炎、関節症性変化/骨増殖性変化、末節骨骨吸収、拘縮、tendon friction rubなどがみられる。 |
| 関節炎を呈する患者では強皮症特異的抗体以外の自己抗体を測定する(1 B 8.7)。 |
| SSc自体の関節炎にMTX(1 B 8.3)、TCZもしくはRTX(2 B 7.9)。GCは使わない(3 C 8.0)、JAK阻害剤は明確な推奨ができない。 |
| SScに合併する関節リウマチにMTX(1 A 8.7)、TCZもしくはアバタセプト(2 B 8.6)。JAK阻害剤は明確な推奨ができない。 |
| 関節可動域評価、関節機能評価を行う(1 B 8.5)。関節可動域低下に作業療法、理学療法を行う(2 B 8.9)。 |
| リハビリテーション |
| SScの機能障害やQOLの評価はHAQ-DIが一般的、呼吸機能評価はSaint George's Respiratory Questionnaireの使用が多く、またCATも使用される。 |
| 手指拘縮の予防や改善に手指屈曲伸展運動は有用(2 B 8.9)。開口制限や仮面様顔貌に対し自動ストレッチ運動は有用で選択肢(2 C 8.6)。末梢循環障害を考え装具療法は行わない(3 C 8.4)。 |
| 間質性肺疾患に呼吸器リハは運動耐容能の改善に有用で選択肢(2 C 8.7)。肺高血圧症に心臓リハも有効な方法があり選択肢(2 C 8.6)。骨格筋障害に筋力強化は筋力改善に有用で選択肢(2 C 8.7)。運動耐容能の改善に筋持久力運動も有用で選択肢(2 C 8.7)。 |
| 生活指導は日常生活で疾患の自己管理を身につける有用な手段であり選択肢(2 C 8.7)。 |
| 小児 |
| 小児SScの診断に成人の診断基準を適応(2 D 8.6)し、SSc全体の1〜9%程度。男性、びまん皮膚硬化型、抗トポイソメラーゼI抗体が多く、血管障害が強い。抗セントロメア抗体は少ない。小児は成人と比べ予後良好だが、一部に心病変を主とする臓器障害が急速進行し致死例もある。 |
| 小児SSc治療薬はエビデンスに乏しく、重症度に応じ成人に準じた薬を使う。GCとDMARD併用(D 8.2)、MTX(C 8.4)、MMF(D 8.4)、シクロフォスファミド(D 8.3)、イロプロスト(D 8.3)、ボセンタン(D 8.3)、TCZ(D 8.2)、RTX(D 8.1)、自家幹細胞移植(D 7.8)。 |
| 移行期は年齢により変化する病態や合併症に留意し移行・転科する診療科や施設を選定する。 |
全身性強皮症の8つの病態に対してMMF、ニンテダニブ、リツキシマブ(RTX)、トシリズマブ(TCZ)を使用する新しい推奨が含まれた。(証拠レベル、推奨度、同意レベル)
文献中の要約図
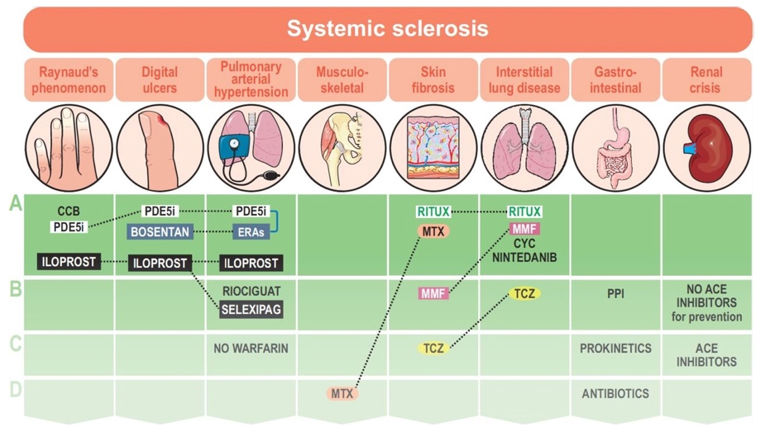
CCB;カルシウム拮抗剤、CYC;シクロホスファミド、ERAs;エンドセリン受容体拮抗薬、MMF;ミコフェノール酸モフェチル、MTX;メトトレキサート、PDE5i;ホスホジエステラーゼ5阻害剤、PPI;プロトンポンプ阻害剤、RTUX;リツキシマブ、TCZ;トシリズマブ
括弧内は(証拠レベル、推奨度、同意レベル)
| レイノー症状 |
|---|
| 1. ジヒドロピリジン系Ca拮抗薬 (通常は経口ニフェジピン) を第一選択として使用する。(1a、A、8.6) 2. PDE5阻害剤(タダラフィル、シルデナフィルなど)も考慮する必要がある。(1a、A、8.6) 3. 経口療法が無効の重症では、静脈内イロプロストを検討する。(1a、A、9.0) |
ニフェジピンはレイノー症状の頻度と重症度を軽減することがRCTで示されている。PDE5阻害剤ではレイノー症状スコア、発作の頻度と持続時間の改善に有意差が見られている(本邦では保険適応なし)。エンドセリン受容体拮抗薬のレイノー症状への有効性に関しての証拠は一定せず。
| 指尖潰瘍 |
|---|
| 1. 指尖潰瘍の治療には、PDE5阻害剤および/または静脈内イロプロストの使用を検討する。(1a、A、8.8) 2. 新規指潰瘍数の減少にはボセンタンを検討する。(1a、A、8.0) |
PDE5阻害剤(シルデナフィル50mg一日2回やタダラフィル20mg隔日投与)や静脈内イロプロスト(0.5~2ng/kg/minを3~5日連続)は指尖潰瘍の改善効果がRCTで示されている。ボセンタン(62.5mgを1日2回)はRCTで新規潰瘍を減らす効果が確認されているが、マシテンタンでの試験では否定的だった。
| 肺動脈性肺高血圧症 |
|---|
| 1. PDE5阻害剤(タダラフィル)とエンドセリン受容体拮抗薬(アンブリセンタン)併用を第一選択として考慮する。(1a、A、8.1) 2. 進行したPAH (クラスIIIとIV) は、エポプロステノール静脈投与を検討する。(1a、A、7.7) 3. 他のプロスタサイクリン類似体(セレキシパグ)またはアゴニストも検討する。(1b、B、7.7) 4. リオシグアトを検討してよい。(1b、B、8.0) 5. 抗凝固薬 (ワルファリン) 使用は推奨されない。(2a、C、8.2) |
AMBITION試験でタダラフィル40mgとアンブリセンタン10mgの併用で肺動脈性高血圧への有効性が裏付けられている。さらにセレキシパグを追加した時の死亡イベントの減少の結果もある。
| 強皮症腎クリーゼ |
|---|
| 1. 診断後はACE 阻害薬を直ちに使用する。(4、C、8.4) 2. ステロイド治療されている場合は、強皮症腎クリーゼを検出するため定期的に血圧をモニタリングする。(3、C、7.9) |
ACE 阻害薬(カプトプリルやエナラプリル)が導入されて以来死亡率が大幅に改善されている。しかし、腎クリーゼの予防に対する推奨までには拡張されていない。プレドニゾロン30mg以上では予後不良な正常血圧の強皮症腎クリーゼが増加している。
| 消化管障害 |
|---|
| 1. 逆流性食道炎の治療、食道潰瘍や狭窄予防にPPIを考慮する。(3、B、8.3) 2. 症状のある消化管運動障害の治療に消化管運動促進薬(ドンペリドンなど)の使用を考慮する。(1b、C、8.0) 3. 小腸細菌異常増殖症(SIBO)の治療は、抗生物質のローテーション使用を考慮する。(2b、D、7.3) |
胃食道逆流症の症状を抑え、食道合併症を予防するためにPPIが推奨されるが、長期服用後の安全性に関する証拠が不足している。SIBOの治療は、抗生物質(キノロン、アモキシシリンークラブラン酸、メトロニダゾール、ネオマイシン、ドキシサイクリンなど好気性と嫌気性最近の両方に効果)の間歇的あるいはローテーション投与は経験的投与に基づくがRCTはない。
| 皮膚硬化 |
|---|
| 1. MTX(1B)、MMF(1B)、RTX (1A) は、皮膚線維症の治療に考慮する。(1a-b、A/B、7.6) 2. TCZは、初期の炎症性びまん皮膚硬化型全身性強皮症の皮膚線維症の治療に考慮して良い。(1b、C、7.2) |
SLS-II試験(2016 Lancet Respir Med)(n=142)では24ヶ月でmRSSがMMF(-4.9)、シクロホスファミド(-5.35)ともに改善したが、後者で白血球減少の有害事象が多かった。N=326の早期dcSSCを対象としたMTX、MMF、シクロホスファミドと免疫抑制なしの患者間では12ヶ月時点でわずかな改善が見られたが、有意差はなし。RTXの有効性報告は日本からの報告(DESIRES試験。週一回投与を4回)。
TCZは第2相と第3相試験(病歴5年未満でCRP0.6mg/dl以上、ESR1時間28以上、血小板33万/ul以上のいずれかを有し、TCZ162mg毎週投与)で有益な傾向が観察された。
| 間質性肺炎 |
|---|
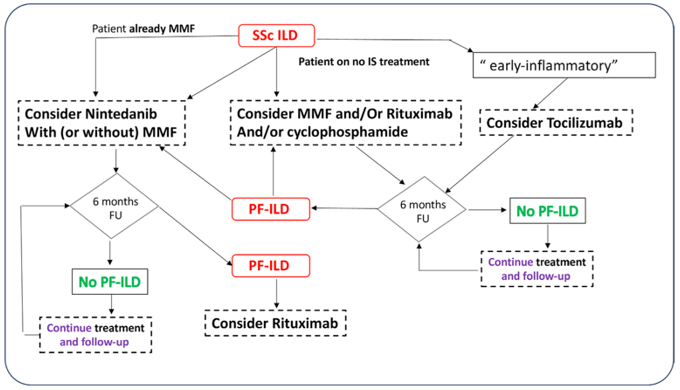
| 1. MMF (1A)、シクロホスファミド (1A)、RTX (1A) はSSc-ILD の治療に考慮する。(1a、A、8.1) 2. ニンテダニブは、単独または MMF との併用で考慮する。(1a、A、8.5) 3. TCZは強皮症間質性肺炎の治療に考慮する。(1b、B、7.8) |
SLS-II試験(2016 Lancet Respir Med)でのMMF(目標1500mgを1日2回で24月)と経口シクロホスファミド(目標2mg/kg/dayで12月その後プラセボを12月)で24月時点で%FVC改善はそれぞれ2.19%、2.88%、白血球や血小板減少の発生率はMMFで少なかった。シクロホスファミドの経口と静脈投与の比較データは不十分。
RECITAL試験(2023 Lancet Respir Med)ではRTXと静注シクロホスファミドが比較され55週目にFVC増加がそれぞれ97ml、99mlで、有害事象はRTXで少なかった。DESIRES試験でもRTXで改善効果が示された。
SENSCIS試験(2019 N Engl J Med)ではMMFとの併用でもニンテダニブ(目標150mgを1日2回)のFVC減少抑制効果が示された(ニンテダニブ -52.4ml/年、プラセボ -93.3ml/年)。
INBUILD試験(2018 N Engl J Med)で自己免疫疾患関連ILDではニンテダニブ単独とプラセボでFVC減少はそれぞれ -75.9 ml/年、-178.6ml/年。
focuSSced試験 (2020 Lancet Res Med)はTCZ第3相(病歴5年未満でCRP、ESR、血小板条件のいずれかを有し、TCZ162mg毎週投与)で副次的アウトカムとして48週で%FVC低下が有意に少なかった(TCZ:プラセボ=-0.4%:-4.6%)。
| 予後不良 |
|---|
| 1. 進行した心肺機能障害がない場合、早期dcSScおよび予後不良の特定の患者の治療に、高強度免疫抑制(通常はシクロホスファミドを含む)に続いて自家造血幹細胞移植を考慮してよいだろう。(1a、A、7.8) |
重症の早期dcSScで予後不良では自家造血幹細胞移植(HSCT)が皮膚病変の改善と肺機能の安定化が示され、考慮されることがあるが、早期治療関連死亡リスクがあり、特に心機能低下では慎重に考慮する必要がある。
| 筋骨格 |
|---|
| 1. MTXは、SScの筋骨格障害の治療に考慮する。(2b、D、7.8) |
ステロイド、TCZ、RTXなどの関節障害に与える質の高い証拠に欠ける。関節障害にアバタセプトの有効性が示された第2相試験がある。