大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
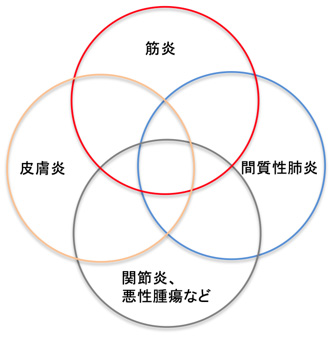
特発性炎症性ミオパチーは、筋肉、皮膚、肺の炎症を中心とし、関節炎など多臓器の障害を特徴とする免疫疾患で、背景に悪性腫瘍を伴うことがある。種々の自己抗体は疾患サブタイプ、癌や間質性肺疾患などの生命予後を左右する合併症の有無と関連し、抗合成酵素抗体症候群(抗ARS抗体症候群、抗synthetase症候群とも)(antisynthetase syndrome)、多発性筋炎(polymyositis)、皮膚筋炎(dermatomyositis)、免疫介在性壊死性ミオパチー(immune-mediated necrotizing myopathy)、重複筋炎(overlap myositis)、封入体筋炎(inclusion body myositis)などのサブグループに分類される。ARS抗体では慢性間質性肺炎、MDA5抗体では急速進行性間質性肺炎、TIF1γ抗体では悪性腫瘍の合併に注意する。
皮膚筋炎はI型インターフェロノパチーと考えられ、その病理組織ではI型IFN経路の活性化を反映して筋繊維でのMxA(myxovirus resistance protein A)発現が特徴的で、皮膚筋炎に対してI型IFNを標的とする治療、また難治性特発性炎症性ミオパチーに対してCD19細胞を標的とする治療が期待されている。
発熱、倦怠感、体重減少などの炎症による全身症状を呈することがある。
筋炎症状として、通常対称性の近位筋の筋力低下が見られ、階段昇降や、立ち上がり困難(登攀性起立、あるいはガワーズ徴候とも)、上肢が挙がりにくい、などの症状を自覚する。頚部筋の筋力低下から枕から頭を上げにくくなる。嚥下筋の障害を生じると体重減少や誤嚥性肺炎を繰り返すなど生活の質が低下する。封入体筋炎を除いて筋肉痛がよく見られる。抗合成酵素抗体症候群や皮膚筋炎では数週間から数ヶ月の亜急性に筋力低下が、免疫介在性壊死性ミオパチーでは急速に筋力低下が進行する。封入体筋炎は徐々に発症し何年もかけて緩徐進行し大腿四頭筋(起立や昇段動作に支障)と深指屈筋の障害(ボタン掛けやペットボトル蓋の開閉に支障)によって特徴付けられる。
頻度は不明確だが心筋炎では軽度の呼吸困難、動悸、胸痛、心原性ショックや突然死まで様々。心臓伝導系の炎症で上室性不整脈を生じることがあるが、不整脈や心不全による死亡はまれである。
皮膚症状として、抗合成酵素症候群ではメカニクスハンドやレイノー現象などが見られる。皮膚筋炎の典型的な皮疹として手指関節背側、肘、膝の伸側などに見られる紅色皮疹・角化性紅斑(ゴットロン徴候)、手指関節背側の角化のつよい丘疹(ゴットロン丘疹)、上眼瞼の浮腫性紅斑(ヘリオトロープ疹)、胸や肩に広がる紅班(ショール徴候)などが見られるが、抗合成酵素症候群でも見られることがある。活動性皮膚筋炎では皮疹に掻痒を伴うことが多い。
皮膚症状は異なる自己抗体と関連し、MDA5抗体では皮膚潰瘍、爪周囲の発赤、掌側指節間関節の痛みを伴う紅斑や丘疹。TIF1γ抗体では全身性浮腫やびらん性の皮疹、紅斑が広がり、メカニクスハンドはMDA5抗体皮膚筋炎、全身性強皮症、混合性結合組織病でも観察されることがある。皮下の石灰沈着は、皮膚筋炎におけるNXP2抗体や重複筋炎での全身性強皮症と関連することが多い。
呼吸器症状には、間質性肺疾患、呼吸筋の衰弱、嚥下障害による誤嚥性肺炎がある。間質性肺炎はMDA5抗体皮膚筋炎の急速進行性間質性肺炎や、抗合成酵素症候群のJo1、PL7、PL12抗体との関連がある。PM/Scl-100、SAE、Ro52抗体の筋炎、SRP抗体の免疫介在性壊死性ミオパチーでも見られる。間質性肺炎が筋炎に先行すると筋炎の診断がなかなかなされないこともある。CTは様々な像(non-specific interstitial pneumonia(NSIP)、organizing pneumonia(OP)、あるいはその組み合わせ、頻度は低いがusual interstitial pneumonia(UIP)) を呈する。急速進行性から慢性、潜行性の呼吸困難と乾性咳嗽まで多岐にわたる。横隔膜障害による呼吸筋力低下が封入体筋炎でよく見られ、免疫介在性壊死性ミオパチーでもまれに見られ、呼吸不全に至ることがある。
その他、関節炎が見られることがあり、主に手の小関節で、多関節性、対称性、非びらん性関節炎として現れ、抗合成酵素症候群(主にJo-1抗体)では関節炎が初発症状となることがある。関節リウマチとの重複筋炎、Ku、RNP、PM/Scl抗体に伴う筋炎、MDA5抗体皮膚筋炎も関節炎が認められる。
また、疾患背景に悪性腫瘍を有することがあり、特に皮膚筋炎、TIF1γ抗体、NXP2抗体、疾患発症時の年齢 > 40歳、免疫抑制療法でも高疾患活動性が持続(以前制御されていた疾患の再発を含む)、嚥下障害(中等度から重度)、皮膚壊死や潰瘍形成などがあると高リスクとされ検索が必要である。抗合成酵素抗体症候群や免疫介在性壊死性ミオパチーは低リスクとされる。後にまとめた特発性炎症性ミオパチー関連がんスクリーニングに関する国際ガイドラインの推奨が公表されている。
NXP2抗体皮膚筋炎は出血および穿孔を伴う消化管障害が報告されている。
筋肉の炎症により筋酵素の漏出を引き起こし、クレアチンキナーゼ(CKまたはCPK)、アルドラーゼ(ALD)、ミオグロビンが上昇する。発熱やCRPなど炎症マーカーの上昇を伴うことがある。筋組織崩壊ではAST、ALT、LDHも上昇し、これらは治療薬(methotrexate、azathioprineなど)による肝障害時にも上昇するため鑑別を要する。免疫介在性壊死性ミオパチーではCKが著しく上昇する。しかし筋炎の2割以下ではCK正常内で、その殆どが皮膚筋炎または封入体筋炎である。皮膚筋炎ではALDのみが上昇することもある。
自己抗体は特発性炎症性ミオパチーの約3分の2で陽性となり、サブグループをなして間質性肺疾患や癌などの筋外症状と関連する。
抗合成酵素症候群はJo1、PL7、PL12、OJ抗体、(稀にEJ、Ha、KS、Zo、Ly、VRS抗体)と関連する。本邦では抗Jo1、PL7、PL12、EJ、KS抗体の5種類のアミノアシルtRNA合成酵素(ARS)に対する抗体をまとめて抗ARS抗体として保険収載検査として測定される。
皮膚筋炎ではMDA5抗体(抗melanoma differentiation-induced gene-5抗体 MDA5はウイルス由来の2本鎖RNAを認識するRIG-I様受容体の一つで自然免疫応答に関与)は筋症状が少ないclinically amyopathic dermatomyositis (CADM)を呈し、その7割では急速進行性間質性肺炎を発症して予後不良となる。TIF1(transcriptional intermediary factor 1)抗体にはTIF1γ抗体とTIF1α抗体があり、本抗体陽性は悪性腫瘍合併率が高く、発症後1-2年は悪性腫瘍に注意する。Mi2抗体(ヒストン脱アセチル化酵素Mi-2 に対する抗体)は間質性肺炎の合併は少なくステロイド反応性が良いとされる。MDA5、TIF1γ 、Mi-2抗体は皮膚筋炎診断基準を満たす患者において保険収載検査となっている。その他にSAE、NXP2抗体も皮膚筋炎と関連する。NXP2抗体は皮膚炎を伴わない皮膚筋炎(DM sine dermatitis: DMSD)のサブタイプと関連し小児に多い。
免疫介在性壊死性ミオパチーはHMGCRとSRP抗体と関連する。
PM-Scl-75、PM-Scl-100、Ku、U1RNP/Sm、U3RNP、RNA Pol、Ro52抗体は筋炎に特異的ではなく、筋炎に関連する結合組織疾患 (重複筋炎など)や、筋障害のない場合でも検出することがある。
封入体筋炎ではcN1A(cytosolic 5'-nucleotidase 1A)抗体は特異度が高く感度は中等度。cN1A抗体はシェーグレン症候群や筋炎を伴わないSLEでも見つかるため臨床症状とともに解釈する。
自己抗体検出は免疫沈降法がゴールドスタンダードだが、日常的に利用できるわけではなく、市販の免疫測定法(Euro-LINE やA-cubeなど)は、筋炎を疑う場合のスクリーニングに有用である。しかし測定法は十分標準化されておらず偽陽性に注意しならが臨床症状を検討する。抗ミトコンドリア抗体は心機能障害を伴う慢性炎症性筋症と関連しているが抗体の病原性は不明確。
筋炎特異的抗体が複数検出されることは滅多にない。
MRI、超音波、FDG-PET などは、診断、疾患活動性の評価、悪性腫瘍のスクリーニングにおいて有用で、筋生検部位の決定や、筋ジストロフィーなどの類似疾患と筋炎の区別に役立つ。MRIでは炎症性変化を反映する浮腫をT2強調で、筋肉の脂肪置換をT1強調で評価する。定量MRIは封入体筋炎患者の疾患進行の高感度マーカーとして確立されている。超音波検査は線維化、脂肪置換、深指屈筋障害の検出に有望である。FDG-PETは筋炎を反映して集積を示すことができる。
筋炎患者の筋電図は通常、早期の筋動員を伴う小さく短い多相性の運動単位活動電位と、特に近位筋における顕著な筋膜刺激性(線維性収縮、陽性鋭波、ミオトニック放電)の特徴が認められる。ステロイド性ミオパチーの筋電図は通常正常で筋炎との鑑別に役立つ。
| 抗合成酵素抗体症候群 | |
|---|---|
| 臨床症状 | 筋力低下、関節炎、間質性肺疾患、皮膚症状(機械工の手や皮膚筋炎様の特徴) |
| 血清CK | 正常〜著明に増加 |
| 自己抗体 | ARS、Jo1、PL7、PL12、OJ、(稀にEJ、Ha、KS、Zo、Ly、VRS) |
| 筋生検 | 細胞浸潤は主に筋周膜や血管周囲に存在し、CD68+マクロファージ、T細胞(CD4+およびCD8+T細胞)、比較的少量のCD20+ B細胞からなる。壊死線維および再生線維は筋束周囲領域でより一般的にみられる。筋束周囲線維における筋膜に補体沈着。MxA発現はなく、多くの筋線維筋膜でMHC II発現が特徴的に観察される。筋周膜の断片化および筋周膜におけるアルカリホスファターゼ陽性。 |
| 皮膚筋炎 | |
| 臨床症状 | 典型的な皮膚症状(ゴットロン丘疹、ゴットロン徴候、ヘリオトロープ疹)および他の皮膚症状(潰瘍、機械工の手など)、筋力低下および間質性肺疾患の有無。 |
| 血清CK | 正常〜著明に増加 |
| 自己抗体 | MDA5は急速進行性間質性肺炎のリスク、TIF1γ、NXP2は癌の高リスク、SAE、HMGCR、Mi2、MDA5は癌の中等度リスク |
| 筋生検 | 筋周膜および血管周囲部位における炎症性浸潤(CD4+ T細胞、マクロファージ、形質細胞様樹状細胞、CD20+ B細胞、まれにCD138形質細胞) 筋束周囲筋線維の萎縮(感度40%と限定的) 筋束周囲筋線維では約50%でMHC I発現上昇、COX欠損、CD56(神経細胞接着分子)染色陽性、MxAの過剰発現(感度71~77%) 散在する壊死性および再生性の筋線維 症例の80%で毛細血管への膜侵襲複合体の沈着 毛細血管密度の減少(筋肉の単位面積あたりの毛細血管数) 電子顕微鏡検査では内皮細胞内の尿細管状封入体が、炎症性細胞浸潤に先行することが多い |
| 免疫介在性壊死性ミオパチー | |
| 臨床症状 | 上下肢の近位筋の筋力低下 |
| 血清CK | 著明に増加 |
| 自己抗体 | HMGCRとSRPは患者の約65%に存在、HMGCRはスタチン製剤使用と癌に関連 |
| 筋生検 | 炎症は殆どなく、主にマクロファージが関与する。自己抗体の有無に関わらず、生検標本全体に壊死した筋線維が散在する。筋線維鞘および筋形質のC5b-9沈着物と変性筋線維におけるp62蓄積の増加。筋線維鞘のMHC I発現は変動的でMCH IIは通常検出されない。 |
| 封入体筋炎 | |
| 臨床症状 | 非対称性の深指屈筋または大腿四頭筋の筋力低下で、嚥下障害を伴うことが多い。発症時の45歳以上で、進行性筋力低下の病歴が1年以上ある。まれな症状:軸筋力低下、単独の嚥下障害、下垂足、顔面両麻痺、四肢近位筋力低下 |
| 血清CK | 正常範囲の上限の15倍以下 |
| 自己抗体 | cN1A(特異性は高く、感度は中程度) |
| 筋生検 | 筋内膜炎(マクロファージと細胞傷害性T細胞が非壊死性筋線維を取り囲み、しばしば侵入する) 筋線維の筋鞘と筋形質におけるMHC I/ IIの強い過剰発現 オートファジー小胞(縁取り小胞)は症例の25~67%に認められない 小胞に隣接してコンゴフィリッヒ性アミロイド沈着物 p62やTDP-43の免疫染色はより感度が高く、ぼろぼろの赤色またはシトクロム酸化酵素陰性線維である細胞質蛋白質凝集体を示す。 |
多発性筋炎/皮膚筋炎の診断基準(厚生労働省2015年改訂)に基づく。鑑別として、CKの上昇を確認した場合、まず心筋梗塞や心筋炎などの重篤な循環器疾患を除外するため、心電図や心筋特異的なCK-MBの測定などにより早期に鑑別しておく。事故による外傷、熱中症、脱水、低カリウム血症、HMG-CoA還元酵素阻害剤などの薬剤、などによる横紋筋融解症で、筋痛、脱力を生じCKが著増することがある。体育会系の激しい運動でもCKが著増することがある。甲状腺機能低下症でもCK上昇するため、鑑別が必要である。また、成人発症の筋ジストロフィーなどでも炎症細胞の浸潤がみられることがあり、鑑別が必要である。高齢者でCKの上昇が数倍程度の場合は封入体筋炎も考慮する。ミオグロビン上昇はないが、CKが上昇する場合はマクロCK血症を疑う。免疫グロブリンがCKと結合し検査上の高値を示す。
| 項目 | |
|---|---|
| 1. | 皮膚症状: ヘリオトロープ疹 or ゴットロン徴候 or ゴットロン丘疹 |
| 2. | 上肢または下肢の近位筋の筋力低下 |
| 3. | 筋肉の自発痛または把握痛 |
| 4. | CKまたはALD上昇 |
| 5. | 筋炎を示す筋電図変化 |
| 6. | 関節炎・関節痛 |
| 7. | 全身性炎症(発熱, CRP, ESR) |
| 8. | 抗ARS抗体(抗Jo1抗体を含む) |
| 9. | 筋生検(Degeneration, cell infiltration) |
症状や徴候をよりよく説明できる疾患がない場合、この分類基準が使用できる。
筋生検なしで合計5.5以上(感度87%、特異度82%)、筋生検ありでは合計6.7以上(感度93%、特異度88%)で特発性炎症性筋疾患とされる。
| 項目 | 生検なし | 生検あり | |
|---|---|---|---|
| 発症年齢 | 疾患に関連すると思われる最初の症状の発現年齢が18歳以上40歳未満 | 1.3 | 1.5 |
| 疾患に関連すると思われる最初の症状の発現年齢が40歳以上 | 2.1 | 2.2 | |
| 筋力低下 | 通常は進行性の上肢近位筋の客観的な対称性筋力低下 | 0.7 | 0.7 |
| 通常は進行性の下肢近位筋の客観的な対称性筋力低下 | 0.8 | 0.5 | |
| 頸部伸筋より頸部屈筋が相対的に低下 | 1.9 | 1.6 | |
| 下肢では遠位筋より近位筋が相対的に低下 | 0.9 | 1.2 | |
| 皮膚症状 | ヘリオトロープ疹 | 3.1 | 3.2 |
| ゴットロン丘疹 | 2.1 | 2.7 | |
| ゴットロン徴候 | 3.3 | 3.7 | |
| 臨床症状 | 嚥下障害または食道運動障害 | 0.7 | 0.6 |
| 検査所見 | 抗Jo-1抗体陽性 | 3.9 | 3.8 |
| 血清CK、LDH、AST、ALTなどの正常上限以上の上昇 | 1.3 | 1.4 | |
| 筋生検 | 筋繊維内には侵入しない筋繊維周囲の単核球の浸潤: | - | 1.7 |
| 筋周囲あるいは血管周囲の単核球の浸潤 | - | 1.2 | |
| 筋束周辺部の萎縮 | - | 1.9 | |
| 縁取り空胞 | - | 3.1 | |
| 1 | 分類基準をprobable以上で満たし、初発症状が18歳以上で、 | |
|---|---|---|
| 1) | 皮膚症状がなく、手指屈筋力低下があり治療反応性が乏しい臨床的特徴、あるいは筋生検で縁取り空胞がみられれば、封入体筋炎。 | |
| 2) | 皮膚症状がなく、手指屈筋力低下や治療反応性が乏しい臨床的特徴がなく、筋生検で縁取り空胞がみられなければ、多発性筋炎か免疫介在性壊死性ミオパチー。 | |
| 3) | 皮膚症状のいずれかがあり、筋力低下症状のいずれかがあれば皮膚筋炎。 | |
| 4) | 皮膚症状のいずれかがあり、筋力低下症状がなければ無筋症性皮膚筋炎。 | |
| 2 | 分類基準をprobable以上で満たし、初発症状が18歳未満で、 | |
| 1) | 皮膚症状のいずれかがあれば若年性皮膚筋炎。 | |
| 2) | 皮膚症状がなければ、若年性皮膚筋炎以外の若年性筋炎。 | |
| 項目 | |
|---|---|
| 1. | 四肢近位筋、頚部屈筋の対称性筋力低下 |
| 2. | 筋原性酵素上昇(CK. ALD, AST, ALT, LDH) |
| 3. | 定型的筋電図所見 i) polyphasic, short, small, motor unit potentials ii) fibrillation, positive sharp waves, increased insertional irritability iii) bizarre high frequency, repetitive discharge |
| 4. | 定型的組織所見:筋線維の変性、壊死、萎縮、再生、炎症細胞浸潤 |
| 5. | 定型的皮膚症状:ヘリオトロープ疹、ゴットロン徴候、関節伸側の落屑性紅斑 |
(推奨の強さ、証拠レベル、同意の中央値)
| 1 若年発症型IIMは、関連がんのスクリーニングはルーチンでは必要ない。(強い、中、8) | |
| 2 封入体筋炎は、関連がんのスクリーニングはルーチンでは必要ない。(強い、中、8) | |
| 3 すべてのIIM患者はがんリスクに関係なく、国または地域固有の年齢および性別に適したがん検診プログラムに引き続き参加する必要がある。(強い、中、9) | |
| 4 新たに発症したIIMのすべての成人患者は、がんリスクの層別化を支援するため、筋炎特異的自己抗体と筋炎関連自己抗体の検査を受ける必要がある。(強い、中、9) | |
| 5 成人発症IIM患者の潜在的がんリスクは、筋炎のサブタイプ、自己抗体、臨床的特徴で層別化する。(強い、中、8) | |
| 高リスク | 皮膚筋炎、抗TIF1γ抗体、抗NXP2抗体、IIM発症時の年齢>40歳、免疫抑制療法でも高疾患活動性が持続(以前制御されていた疾患の再発を含む)、嚥下障害(中等度から重度)、皮膚壊死や潰瘍形成。 |
| 中リスク | CADM、多発性筋炎、IMNM、抗SAE1抗体、抗HMGCR抗体、抗Mi2抗体、抗MDA5抗体、男性。 |
| 低リスク | 抗synthetase症候群(ASSD)、重複IIM-CTD関連筋炎、抗SRP抗体、抗Jo1抗体、非Jo1 ASSD、筋炎関連抗体(抗PM-Scl抗体、抗Ku抗体、抗RNP抗体、抗SSA/Ro抗体、抗SSB/La抗体)、レイノー現象、炎症性関節症、間質性肺疾患。 |
| 6 成人発症IIMで高リスク因子2つ以上は「関連がん高リスク」。(強い、中、8) | |
| 7 成人発症IIMで中リスク因子2つ以上または高リスク因子1つのみは「関連がん中リスク」。(強い、中、7) | |
| 8 成人発症IIMで推奨6、7の「高」「中」リスク定義を満たさなければ「関連がん標準リスク」。(強い、中、8) | |
| 9 「基本がん検診」は、(国、地域固有の年齢や性別に適した一般がん検診プログラムに加え)以下の検査を含める。総合的な病歴、総合健康診断、血球、肝機能、血沈、CRP、血清タンパク質電気泳動と遊離軽鎖、尿検査、胸部単純XP。(強い、低、7) | |
| 10 「強化がん検診」は以下を含む。首、胸部、腹部、骨盤のCT、子宮頸部検診、マンモグラフィー、前立腺特異抗原、CA125、卵巣がんの骨盤/経膣エコー、便潜血。(強い、低、8) | |
| 11 「関連がん標準リスク」では、IIM診断時に「基本がん検診」を受ける。このスクリーニングは一般人を対象とした国や地域固有の年齢および性別に適したスクリーニングプログラムに追加される。(強い、NA、8) | |
| 12 「関連がん中リスク」では、IIM診断時に「基本がん検診」と「強化がん検診」を受ける。(強い、NA、8) | |
| 13 「関連がん高リスク」では、IIM診断時に「強化がん検診」と「基本がん検診」を受け、さらに「基本がん検診」を3年間毎年受ける。(強い、NA、8) | |
| 14 IIM診断時検査で基礎がんが検出されなかった「関連がん高リスク」では、PET-CTを検討する。(条件による、低、8) | |
| 15 40歳以上で発症、追加の「高リスク」臨床症状が1以上ある抗TIF1γ抗体陽性皮膚筋炎患者に単一のスクリーニング検査として、PET-CTを検討する。(条件による、低、8) | |
| 16 IIM診断時検査で基礎がんが検出されなかった「関連がん高リスク」は、上下部消化管内視鏡検査の実施を検討する。(条件による、非常に低、8) | |
| 17 上咽頭癌リスクの上昇地域では、成人発症IIM診断時に経鼻内視鏡検査を検討する。(条件による、非常に低、8) | |
| 18 リスクカテゴリーに関係なく、以下の危険症状や特徴を持つすべてのIIM患者に対してがん検診を考慮する。意図しない体重減少、がんの家族歴、喫煙、原因不明の発熱、寝汗。(条件による、非常に低、9) | |
特発性炎症性筋疾患(IIM)関連がんスクリーニングに関する国際ガイドライン推奨
通常大量のステロイド薬(プレドニゾロン換算で0.75~1mg/kg)から開始し3-4週間維持したあと、2-3週間隔で10%づつ(もしくは週5mg程度づつ)減量する。ステロイド減量時に再燃するようなら免疫抑制剤(azathioprine、tacrolimus(多発性筋炎・皮膚筋炎に合併する間質性肺炎に適用)、cyclosporine(保険適用外)、methotrexate(保険適用外)など)を併用する。免疫抑制薬の併用がステロイド減量を容易にする場合がある。
難治症例に対しては、ガンマグロブリン大量静注療法を検討してよい。嚥下障害をきたすと筋炎沈静化後も障害が長く続くことがあり、免疫抑制薬の併用、ガンマグロブリン投与も含めた早期からの積極的治療を検討する。免疫抑制剤に抵抗性の多発性筋炎に対してtocilizumabの投与によって軽快した症例を当科より報告した。
悪性腫瘍、あるいは心筋障害や難治性間質性肺炎を合併すると予後は不良となる。悪性腫瘍合併では腫瘍の治療を行なう。筋症状を伴わない皮膚筋炎のCADMでは急速進行性の重篤な間質性肺炎を合併することがあり、早期にcyclophosphamide pulse療法を含む強力な免疫抑制療法を必要とし、場合によってはcyclosporineなども併用する。特にフェリチン高値を伴う場合は予後不良である。
治療に大量のステロイドを使用するためステロイドによる筋量の減少が見られることがある(ステロイドミオパチー)。CK値が正常化しているにもかかわらず筋力の回復が遅れる、あるいは筋力低下が進行する場合、ステロイドミオパチーの合併に気をつける。長時間作用性のフッ化ステロイドでおこしやすい。%クレアチン尿 = 尿中クレアチン(g/day) / [尿中クレアチン(g/day)+尿中クレアチニン(g/day)] を測定する。健常人では10%未満であるがステロイドミオパチーでは上昇する場合がある。経時的測定も大切である。この機序による筋力低下はステロイド減量によって徐々に回復する。
数ヶ月以上の緩徐進行性の経過をたどる炎症と変性を伴う筋疾患で50歳以上の男性に多く、多発性筋炎と誤診されやすい。難治性の多発性筋炎とされていることもある。多発性筋炎と異なり、初期では手指屈筋が侵され、ものを落としたり、ふたを開けにくいなどの末梢筋力低下による症状が目立つことが重要な特徴である。筋障害は左右非対称のこともある。大腿四頭筋も侵されやすく転倒や歩行時の膝折れを生じ、さらに嚥下障害や頭部保持の障害なども現れてくる。
CPK値は正常から上限値の数倍程度で10倍を越えることはない。炎症マーカーの上昇はなく自己抗体も通常は検出されない。筋電図は筋原性あるいは筋原性と神経原性が混合する。MRIでは多発性筋炎は筋膜面での炎症信号が目立つが、封入体筋炎では筋全体に広がり、脂肪浸潤や筋の萎縮が目立つと報告されている。筋生検では多発性筋炎でみられるような主にCD8+T細胞浸潤による筋繊維の傷害と、空砲形成やアミロイド関連蛋白質の蓄積による変性の両方がみられる。凍結組織では筋線維の形質に辺縁好塩基性の空胞が確認できる。抗NT5C1A抗体(抗5'-nucleotidase, cytosolic 1A抗体)が本疾患で検出されることがある。
末梢筋力の低下と緩徐進行性の臨床経過とともに筋生検所見で診断する。治療では高用量ステロイドや免疫抑制剤(MTXやアザチオプリン)にて筋酵素が低下することはあるが、筋力の回復が得られず、筋力低下の進行を止めることが治療目標になることが多い。リハビリテーションを行ない、杖や歩行補助装具などを使用する。ミオスタチン受容体のアクチビンタイプII受容体阻害抗体(bimagrumab)などの有効性の治験報告もある。