大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
ハイドロキシクロロキン(HCQ)は禁忌がない限りすべてのSLE患者に対する標準治療である。
グルココルチコイド(GC)は、主に免疫による炎症の初期の抑制と再燃時に必要に応じて使用するが、できるだけ早く減量する。
免疫抑制剤 (従来型や生物製剤) はSLEの制御 (寛解または低レベル疾患活動性)、SLE関連の病的状態や死亡率の低減、およびGC毒性の最小化を達成するため、SLEの活動性に対して早期の導入が推奨される。
(すべての治療推奨は、SLE以外の病因を除外するための適切な検査が行われ、臓器別の治療推奨は治療禁忌がない限り全患者でHCQ服用が前提。)
SLE(腎症は除く)管理推奨まとめ(Sammaritano LR et al. Arthritis Rheumatol. 2025 Figure 1)
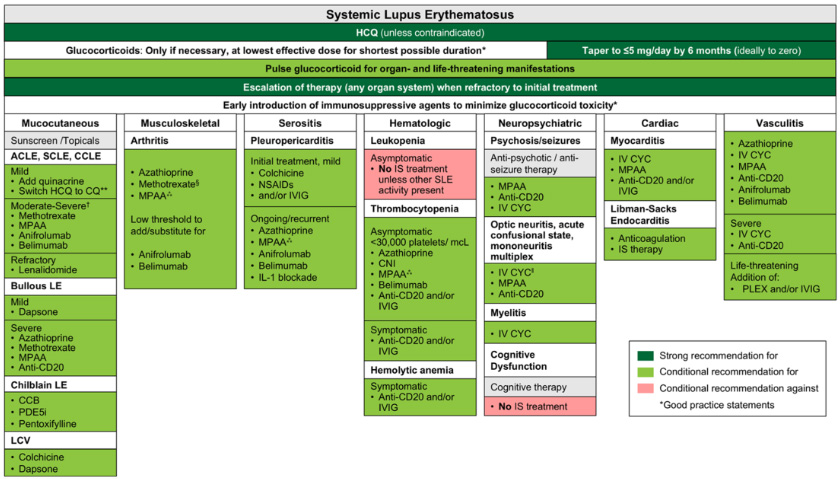
| モニタリング | |
|---|---|
| SLEには、臨床状態や治療薬に変更がある時を含め、定期的に疾患活動性を評価する。 | |
| 少なくとも年1回、疾患による障害を評価する。 | |
| 併存疾患とリスク管理 | |
| GPS(good practice statement):全患者は、SLEと治療関連の疾患(感染症、心血管疾患、骨・関節障害、悪性腫瘍、生殖関連合併症、抗リン脂質抗体など)のスクリーニング、モニタリング、管理を受ける。 | |
| 服薬ガイダンスと治療目標 | |
| GPS:SLEの治療目標では、長期的な臨床転帰を改善させるため、疾患を最適に制御する(寛解または低レベル疾患活動性)。 GPS:急性炎症を迅速に抑えるため、必要最少量と最短期間でGCを速やかに処方し、GCの副作用を最小限に抑えるため免疫抑制剤を早期に開始。 |
|
| グルココルチコイド(GC) | |
| 臓器・生命を脅かす | mPSLパルス(250~1,000mg 1~3日間投与)と経口GCの漸減を、パルスなしの高用量経口GCの漸減よりも条件付きで推奨 |
| 5mg/日以上で安定 | 6ヶ月以内にPSL 5mg/日以下(理想は0mg)まで漸減を強く推奨 |
| 5mg/日以下で持続寛解 | PSL 0mgまで緩徐に漸減することを条件付きで推奨 |
| 5mg/日以下まで漸減できない | 免疫抑制療法の開始や増量を条件付きで推奨 |
| ハイドロキシクロロキン(HCQ) | |
| SLEでは禁忌を除き、HCQによる定期治療を強く推奨 | |
| SLEでは持続的寛解が得られた場合も、HCQの無期限継続を条件付きで推奨 | |
| HCQ療法を受けているSLE患者 | 網膜毒性を最小限に抑えるため、HCQの長期平均投与量目標を5mg/kg/日超ではなく5mg/kg/日以下を条件付きで推奨 治療開始時や病勢制御維持のため、短期間高用量(5~6.5mg/kg/日)が必要となる場合がある |
| 免疫抑制剤 | |
| 持続的臨床寛解、低疾患活動性 | 3~5年後に免疫抑制療法を漸減し中止を条件付きで推奨 |
| 一般的治療戦略 | |
| GPS:活動性SLE症状のある場合、疾患活動性の重症度に応じ、投与量と投与方法を選び、速やかに診断治療する。 GPS:SLE発症時や再燃時に複数臓器が障害されている場合、治療はすべての症状を対象とするが、不可逆的障害リスクが最も高い部位を優先する。 GPS:臓器や生命を脅かすSLEは、緊急に積極的治療(例:パルス療法/高用量GC療法および免疫抑制療法)を行う。時間制約により連続治療が不可能な場合があるため、併用療法も考慮。具体的な併用療法は、臨床状況と患者の希望に基づき決める。 GPS:リウマチ科の診療範囲を超える薬物、処置、手術が検討される場合、リウマチ専門医と関連専門医/処置医/外科医の間でその治療を行うか多職種協議を行う。 GPS:臨床所見や血清学的所見がSLEとの重複または追加診断を示唆する場合(例:既知のSLEにAQP4抗体検出、新規発症の横断性脊髄炎や視神経炎)、どの病態が優勢かで、必要に応じて専門医と相談しながら治療を調整する。 |
|
| 臓器特異的異常 | |
| 初期治療に抵抗し臓器でSLE疾患活動性が持続するときは、治療強化を強く推奨 | |
| 血液系異常 | |
| 無症状のNeuやLym減少(いずれも1,000/μL未満) | 他の疾患活動性がない場合、免疫抑制療法(GC、従来の免疫抑制剤、生物制剤)の開始は条件付きで推奨しない |
| 慢性の無症候血小板減少(30,000/μL未満) | GCと追加療法(MMF、AZA、CNI、RTX、ベリムマブ、IVIG)の開始を、経過観察やGC単独よりも条件付きで推奨 (30,000/μL以上で無症候性では無治療) |
| 症候性血小板減少(活動性の有意な出血) | IVIGやRTXを追加したGC療法を、従来の免疫抑制剤の追加より条件付き推奨 |
| 症候性溶血性貧血(虚血、血行動態不安定性) | IVIGやRTXを併用したGC療法の初回投与を、従来の免疫抑制剤の追加よりも条件付きで推奨 |
| 神経精神異常 | |
| 活動性視神経炎、急性錯乱状態、活動性多発単神経炎 | パルス/高用量GCの漸減と、IVCY、MMF、RTXなどの免疫抑制療法併用の初期治療を、パルス/高用量GC単独よりも条件付きで推奨 |
| 活動性ループス脊髄炎 | パルス/高用量GCとIVCYによる初期治療を、パルス/高用量GCとIVCY以外の免疫抑制剤よりも条件付きで推奨 |
| 活動性ループス精神病 | 抗精神病薬とGC、IVCY、MMF、RTXなどの併用を、抗精神病薬単独よりも条件付きで推奨 (重症、難治性では血漿交換やIVIG) |
| 活動性SLEによる痙攣 | 抗てんかん薬とGC、CYC、MMF、AZA、RTXなどの併用を、抗てんかん薬単独よりも条件付きで推奨 |
| 神経心理学的検査で確認されたSLEによる単独の認知機能障害 | 認知療法単独ではなく、免疫抑制療法(GCを含む)の追加は条件付きで推奨しない |
| 皮膚/粘膜皮膚障害 | |
| GPS:発疹や病状再燃リスクを減らすため、日焼け止めや他の日焼け防止を指導する。 GPS:皮膚ループスの初期治療は、HCQに加え、GCやカルシニューリン阻害薬の外用薬や、皮膚科医による病変内へのGC投与や、短期間の経口GCも含むことがある。 |
|
| HCQや外用薬でも続く軽度な皮膚ループス | 免疫抑制剤の追加より、抗マラリア剤の修正(キナクリンの追加またはクロロキンへの切り替え)を条件付きで推奨 (キナクリンは網膜症リスクとは関連なく、クロロキンはHCQより網膜毒性高い) |
| 外用薬、HCQ、経口GCでも続く中~重度の皮膚ループス | MTX、MMF、アニフロルマブ、ベリムマブなどの追加を条件付きで推奨 |
| さらに抵抗性の中~重度の皮膚ループス | レナリドミド(本邦では適応なし)の追加または代替を条件付きで推奨 |
| 外用療法やHCQでも続く軽度水疱性ループス | ダプソンの初期追加を、GC開始よりも条件付きで推奨 (ダプソンで溶血性貧血きたすことありG6PDを評価) |
| 外用薬、HCQ、経口GCに抵抗性の中~重度の水疱性ループス | 従来の免疫抑制剤(MMF、MTX、AZA)やRTXの追加を条件付きで推奨 |
| 外用薬、HCQ抵抗性の凍瘡状ループス | ペントキシフィリン、PDE5阻害薬(シルデナフィル、タダラフィル)、Ca遮断薬(ニフェジピン)追加を免疫抑制よりも条件付きで推奨 |
| 外用薬、HCQでも続く軽度の皮膚血管炎 | ダプソンやコルヒチンの追加を、経口GCを含む免疫抑制よりも条件付きで推奨 |
| 漿膜炎 | |
| ループス胸膜心膜炎 | NSAID、コルヒチン、両者併用や、閾値の低いGC療法への強化による初期治療を、GC単独よりも条件付きで推奨 |
| 治療抵抗性で胸膜心膜炎の持続や再発 | 従来の免疫抑制(MMF、AZA)や生物製剤を条件付きで推奨 |
| 筋骨格系 | |
| GPS:急性または再発性関節炎の初期治療に、推奨される長期治療の効果が出るまで、NSAIDsや経口GCの限定的投与を含む。 | |
| NSAID、短期GCの有無にかかわらず、HCQ服用中の活動性関節炎 | MTX、MMF、AZAによる初期治療と、不十分な場合は低い閾値でベリムマブまたはアニフロルマブの追加や代替を、初期治療での生物製剤よりも条件付きで推奨 (ジャクー関節症にはコンセンサスは得られなかった) |
| 全身性血管炎 | |
| 活動性SLEによる血管炎 | パルス/高用量GCの漸減と従来の免疫抑制剤(IVCY、MMF、AZA)や生物製剤(RTX、ベリムマブ、アニフロルマブ)を、GC単剤よりも初期治療として条件付きで推奨 |
| SLEによる重症血管炎 | IVCYやRTXの初期治療を、他の免疫抑制剤より条件付き推奨 |
| 生命を脅かす血管炎(びまん性肺胞出血、腸間膜血管炎など) | パルス/高用量GCの漸減と免疫抑制剤に、血漿交換やIVIG追加を、GCと免疫抑制剤よりも条件付きで推奨 |
| 心臓・肺障害 | |
| 急性・増悪期のループス心筋炎 | GCとIVCY、MMF、RTX、IVIGなどの併用を、GC単独より条件付きで推奨 |
| リブマン・サックス心内膜炎 | 免疫抑制療法や抗凝固療法を条件付きで推奨 (非細菌性心内膜炎はaPLと関連し、抗凝固療法が一般推奨) |
併存疾患に関するガイダンスと管理の提案
| 一般 | |
|---|---|
| ライフスタイル | 身体活動、睡眠、運動療法、日光の防御、禁煙、心理社会的介入 |
| 心血管の健康 | |
| ASCVDリスク | SLEはリスクを高める要因 リスク計算ツールを用いて評価し、従来のリスク要因を管理 |
| 感染症スクリーニング | |
| HBV | 一般:成人は生涯に少なくとも1回 免疫抑制療法(用量/期間に応じたGCを含む)前の全患者 |
| HCV | 一般:成人は生涯に少なくとも1回(HCV有病率0.1%未満は除く) 免疫抑制療法(用量/期間に応じたGCを含む)前の全患者 |
| 結核 | 成人:生物製剤(および標的合成製剤)の免疫抑制剤の前 従来の免疫抑制剤、他の免疫抑制剤、GC(用量や期間に応じ)の前 小児および青年:生物製剤の前 |
| HIV | 成人:生物制剤の前 従来の(および標的合成)免疫抑制剤、他の免疫抑制剤、GC(用量や期間に応じて)の前 |
| ワクチン接種 | |
| インフルエンザ、肺炎球菌、組換えVZV | 18歳以上で免疫抑制療法を受けている場合 |
| COVID-19 | 生後6ヶ月以上の全年齢で中~重度の免疫不全状態(初回と追加) |
| RSV | 60~74歳の成人の免疫不全でリスクが高い場合 |
| HBV | 19~59歳の成人 60歳以上の成人でリスク因子を有する 19歳未満の小児/青年 |
| HPV | 26~45歳で免疫抑制療法を受けている(過去にワクチン未接種) すべての小児/青年/若年成人(9~26歳) |
| 感染予防 | |
| PCP肺炎 | 高用量GC(PSL15~30mg/日以上で2~4週間以上)を受ける患者 注:臓器移植以外では予防は議論の余地があり、SLEでのリスクは非常に低い(0.4%) GCと免疫抑制剤の併用、間質性肺疾患が併存、リンパ球減少(500未満)などが高リスク |
| HBV | B型肝炎の(1)血清プロファイルと(2)免疫抑制療法に基づき判定 (1)血清学的プロファイル: ・高リスク:HBsAg陽性かつHBcAb陽性。 ・低リスク:HBsAg陰性かつHBcAb陽性 (2)免疫抑制療法: ・高再活性化リスク(>10%)(B細胞除去や中~高用量GC 20 mg/日を超えて4週間以上の)では予防療法を実施 ・中再活性化リスク(1~10%)(TNFや他のサイトカイン阻害薬)では予防療法を考慮 ・低再活性化リスク(<1%)(従来の免疫抑制薬)はモニタリングのみ |
| 骨の健康 | |
| GC常用なしでのスクリーニング | 65歳以上の女性全員と65歳未満でリスクある閉経後女性 男性には推奨なし |
| GC 2.5mg以上3ヶ月以上でスクリーニング | 40歳以上:FRAXとBMDに加え、椎体骨折評価や脊椎X線検査 40歳未満:BMDに加え、椎体骨折評価や脊椎X線検査 |
| 治療 | ACRガイドラインに従い骨折リスクを評価、中等度以上の骨折リスクの全員に経口BP製剤(または代替薬) 非常に高リスクはBPよりデノスマブや副甲状腺ホルモンを検討 |
| がんスクリーニング | |
| 一般 | 一般集団スクリーニングのすべての項目を遵守する CYC療法の既往歴は、尿細胞診スクリーニングを検討 |
| 子宮頸がん | 免疫抑制剤使用の有無にかかわらず、SLEの全女性はHIV感染女性のスクリーニングガイドラインに従う |
| 生殖関連 | |
| 避妊 | IUDまたは皮下プロゲスチンインプラントが望ましい 活動性SLEやaPL陽性では、エストロゲン含有薬は使用しない MMF服用では、IUDまたは2つの避妊法を使用する |
| 妊孕性 | 活動性SLEの場合は、生殖補助医療を延期する aPL陽性では、低分子量ヘパリンを用いて卵巣刺激を行う 毎月IVCYでは妊孕性温存: ・女性:ゴナドトロピン放出ホルモン作動薬の併用療法 ・男性:治療前の精子凍結保存を検討 |
| 妊娠 | 活動性SLEの場合は妊娠を延期 臓器障害が著しい場合は妊娠を避ける 妊娠併用可能薬剤で4~6ヶ月間疾患活動性が安定/低くなった後に妊娠を試みる 妊娠中毒症予防のための低用量アスピリン HCQ(禁忌でない場合) aPLおよび抗Ro/La抗体の評価、モニター、治療を行う |
| 更年期 | 活動性SLEやaPL陽性の場合はホルモン補充療法を避ける |
| 薬物毒性 | |
| GC | GC漸減時には離脱症候群や副腎機能不全を評価する これらは非特異的SLE症状に類似することがある |
HCQ、ステロイド、免疫抑制剤(MTX、MMF、AZA、シクロホスファミド)、カルシニューリン阻害剤(CyA、TAC)、および生物製剤(ベリムマブ、アニフロルマブ、RTX)の使用、治療戦略と目標、評価、併用と逐次療法、薬の漸減について意見された。HCQ は病勢と網膜毒性を考慮し、目標量5mg/kg実体重/日で全ての患者に推奨。ステロイドは疾患活動性期間の「橋渡し治療」とし、維持療法は5mg以下最小限にして可能なら中止。疾患制御とステロイドの漸減/中止を促進するため、免疫抑制剤(MTX、AZA、MMF) 、生物学的製剤 (アニフロルマブ、ベリムマブ) の迅速な開始を考慮する。臓器を脅かす疾患ではシクロホスファミドが、難治性疾患ではRTXを考慮する。活動性ループス腎炎は、ステロイド、MMFまたは低用量のIVCYを中心に、ベリムマブやTACの追加を考慮する。
HCQヒドロキシクロロキン、MTX メソトレキサート、AZA アザチオプリン、CyA シクロスポリン、TAC タクロリムス、RTX リツキシマブ、IVCY 静注シクロフォスファミド
| 包括的原則(文末の数字は同意レベル) |
|---|
| A. SLEの管理は患者と社会のコストを考慮し、患者教育と共有された意思決定による学際的な個別管理が必要だ。(9.88) |
| B. SLEの疾患活動性は、臓器障害の評価 (少なくとも年1回) とともに、来院ごとに(頻度は医師の裁量)検証済みの方法(SELENA-SLEDAI、SLEDAI-2K、BILAGなど)で評価する。(9.74) |
| C. 長期的な転帰の改善に、日焼け止め、禁煙、健康的でバランスの取れた食事、定期的な運動、骨の健康を促進する手段など非薬理学的介入が重要。(9.90) |
| D. 投薬は、患者の特徴、臓器障害の種類と重症度、治療関連のリスク、併存疾患、進行性の臓器障害のリスク、および患者の好みによって決定される。(10) |
| E. SLEの早期診断 (血清学的評価を含む)、臓器障害 (特に腎炎)の定期的スクリーニング、寛解(寛解が不可能な場合は低疾患活動性)を目指した迅速な治療の開始、治療の厳格な遵守は、再燃および再発を防ぐために不可欠で、臓器障害を軽減し、予後を改善し、生活の質を向上させる。(9.81) |
| 推奨/提言(文中は証拠レベル/推奨グレード。文末の数字は同意レベル) |
|---|
| 1. HCQは、禁忌でない限り全ての患者(1b/A)に、目標量5mg/kg実体重/日 (2b/B)で推奨されるが、再燃(2b/B)と網膜障害のリスクで増減させる。(9.21) |
HCQは主なSLE治療薬である。5mg/kg以下だと再燃リスク2倍。腎疾患、黄斑疾患、網膜疾患、タモキシフェン使用などが網膜障害リスクなので眼科での緻密なモニターが必要。
| 2. ステロイドは必要に応じ臓器障害の種類と重症度によって投与(2b/C)、維持用量 ≤5 mg/日(プレドニゾン相当量)(2a/B)に減らし、可能なら中止する。中等から重症はmPSLパルス(125~1000mg/日、1~3日間)を検討する(3b/C)。(9.57) |
ステロイドの使用を最小限にすることが今回の主要な議論だった。ステロイドの慢性暴露が主要な副作用のリスクであり、目標維持量が2019年版のプレドニゾン7.5mgから5mgに下げられ、ステロイドは完全中止を目指して「橋渡し療法」としての位置付けである。mPSLパルスは重症度と体重に応じた量で投与し、その後の経口ステロイドの早い減量を可能にする。
| 3. HCQ(単独またはステロイド併用)に反応しない、またはステロイドを長期使用が許される量未満に減らせない場合、免疫抑制剤MTX(1b/B)、AZA(2b/C)、MMF(2a/B)、生物製剤ベリムマブ(1a/A)、アニフロルマブ(1a/A)を考慮する。(9.32) |
生物製剤は腎外SLEに対して承認されたが、疾患活動性を下げ、再燃やステロイド量を減らす。ベリムマブとアニフロルマブの間の直接比較はなく、今の時点では病態の選択性は示されてはいない。従来の免疫抑制剤も引き続き使用が同意された。
| 4. 臓器や生命を脅かす疾患はIVCY(2b/C)を考慮する。難治性ではRTX(2b/C)が考慮される場合がある。(9.38) |
生殖毒性のため高用量IVCYは重篤な症例のみ使用。RTXは免疫性血球減少などを除いて他の薬剤が無効な時に推奨される。IVCYとRTXの組み合わせは利点がない。いずれにも反応しない場合は、血漿交換、造血幹細胞移植、治験など他の選択肢もある。2022年に重症難治性SLE5名にCART細胞療法が有望な結果で発表されたが長期データが必要だ。
| 5. 活動性皮膚疾患は外用薬(ステロイド、カルシニューリン阻害剤)(2b/B)、抗マラリア薬(HCQ)(1a/A)、必要に応じて全身性ステロイド(4/C)を含める。二次療法としてMTX(1b/B)、MMF(4/C)、アニフロルマブ(1a/A)、ベリムマブ(1a/B)は考慮される。(9.35) |
第一選択は外用薬、抗マラリア薬、全身性ステロイド。皮膚病変の経験のある皮膚科医とともにダプソン、レチノイド、カルシニューリン阻害剤、AZA、シクロフォスファミド、RTXなどを第2選択、第3選択として考慮できる。MTXとMMFは同様の奏効率65%。アニフロルマブとベリムマブもともに皮膚粘膜症状に有効性を示す。活動性皮膚病変指標ではアニフロルマブの効果が示された。
| 6. SLEによる活動性精神神経疾患は、炎症症状に対してステロイドや免疫抑制剤 (1b/A)、アテローム血栓症/抗リン脂質抗体関連症状に対しては抗血小板剤/抗凝固剤(2b/C) を考慮する。(9.68) |
脊髄症や急性錯乱状態ではIVCYやRTXなどの強力な免疫抑制剤が優先される。生物製剤は臨床試験では活動性精神神経疾患を有する患者は除外されており、有効性の証拠は不足。
| 7. 重度の自己免疫性血小板減少症の急性期治療は、高用量ステロイド(mPSLパルスを含む)(4/C)にIVIG(4/C)追加も可能、またはRTX(2b/B)や高用量IVCY(4/C)、それに続く維持療法はRTX(2b/B)、AZA(2b/C)、MMF(2b/C)、またはシクロスポリン(4/C)を考慮する。(9.48) |
血小板2~3万/mm3以下で治療適応。IVIGありなしによらずステロイドパルスやプレドニゾン0.5~0.7mg/kg/日。RTXはITPで有効性が示されている。ITPではMMFを使用すると再発が減少する。薬剤抵抗性ではトロンボポエチン受容体アゴニストや摘脾が選択肢になるが、TPOアゴニストを先に使用する。
| 8. 活動性増殖性ループス腎炎患者は、低用量(ユーロループス)IVCY(1a/A)、またはMMF(1a/A)とステロイド(mPSLパルスとその後減量して経口)、ベリムマブ(IVCYまたはMMF(1b/A)のいずれかと)またはカルシニューリン阻害剤(特にMMFと組み合わせたボクロスポリンまたはタクロリムス、1b/A)との併用療法を考慮する。(9.36) |
低用量IVCYや、ステロイド+MMF、の標準療法にベリムマブを併用すると標準療法単独よりも再燃を55%減少させGFRが良好に維持される。カルシニューリン阻害薬にはネフローゼ状態の蛋白尿の減少効果がある。腎炎に対する治療奏功率を上げるためベリムマブやカルシニューリン阻害薬の早期併用が考慮されたが、高額医療や一部患者の過剰治療の指摘がある。アジア人の集団で高用量IVCYに対するMMFとTAC併用療法の優位性が確認されている。ステロイドは感染症などの安全上の懸念がない限り寛解導入でmPSLパルス250~1000mgを1~3日間が推奨され、その後、経口0.3~0.5mg/kg/日。原則として累積ステロイド量を減らす。
| 9. 腎反応後ループス腎炎の治療は少なくとも3年継続する(2b/B)。最初にMMF単独、またはベリムマブやカルシニューリン阻害剤との併用で治療を受けた患者は、これらの薬剤の投与継続(1a/A)。一方、最初にIVCY単独(1a/A)やベリムマブ併用(1a/A)で治療を受けた患者は、シクロホスファミドの代わりにMMFまたはAZAを投与する。(9.56) |
初期治療の目標は2019EULAR/ERA-EDTA目標に従って腎反応をモニタリングする(尿蛋白減少が3ヶ月で25%以上、6ヶ月で50%以上、1年で0.5~0.7g/日、GFRの低下は基礎値から10%以内)。MMFとカルシニューリン阻害薬は寛解導入には良いが、長期の維持療法として投与するとカルシニューリン阻害薬の腎毒性やGFR低下と関連する。
| 10. 腎不全のリスクが高い患者(GFRの低下、細胞半月またはフィブリノイド壊死の組織学的存在、または重度の間質性炎症)は、mPSLパルス併用で高用量IVCY(NIHレジメン)(1a/A)が考えられる。(9.57) |
腎機能障害が進行する例があるが、臨床試験ではGFR30未満(ベリムマブのBLISS試験)やGFR 45未満(ボクロスポリンのAURORA試験)では除外されておりこれらの薬剤の有効性は不明だ。こうした患者でも昔の試験データでは高用量IVCYで改善を見ている。
| 11. 持続的寛解を達成したら最初にステロイドを中止、その後に投薬を徐々に減らしていくことを考慮する。(9.89) |
ステロイドは完全離脱に向けて徐々に漸減する。免疫抑制剤の中止に関してはループス腎炎では治療期間と中止前の寛解期間が特に重要で、中止前に少なくとも3~5年間の治療と、少なくとも2年間寛解状態にある必要がある。また、漸減を非常に徐々に行う必要がある。HCQは許容できない副作用がない限りは継続する。
| 12. 抗リン脂質症候群 (APS) を伴うSLEは、最初の動脈血栓イベントまたは原因不明の静脈血栓イベントの後には長期のビタミンKアンタゴニストで管理する(1b/B)。APSはないが高リスクプロファイル(2a/B)を持つSLE患者では低用量アスピリン(75~100 mg/日)を考慮する。(9.57) |
SLE関連APSは原発性APSの治療に従う。ループスアンチコアグラント陽性、2種類の検査陽性、3種類の検査陽性では一次予防に低用量アスピリンを考慮する。HCQは抗血栓効果を有しSLE関連APSでは特に推奨される。3臓器以上に及ぶCAPSでは抗凝固、高用量ステロイド、血漿交換の3重の治療にIVIGを考慮。補体介在性のTMA(微小血管性溶血性貧血/血小板減少症/急性腎障害)の特徴を有するCAPSにはC5阻害抗体エクリズマブの有効性の報告がある。
| 13. 感染症(帯状疱疹ウイルス、ヒトパピローマウイルス、インフルエンザ、新型コロナウイルス感染症、肺炎球菌)の予防接種、骨の健康、腎保護、心血管リスクの管理、悪性腫瘍のスクリーニングを行う(5/D)。(9.85) |
感染症/敗血症の迅速な特定と管理は SLE において不可欠で、強力な免疫抑制剤 (例、高用量 ステロイド、IVCY、RTX) の投与では日和見感染症を注意深く監視する。腎保護作用のあるACE阻害剤やARBを用いて130/80mmHg以下を目指す。GFRが60~90ml/minや尿蛋白が0.5~1g/日ではSGLT-2阻害剤を考慮して良い。
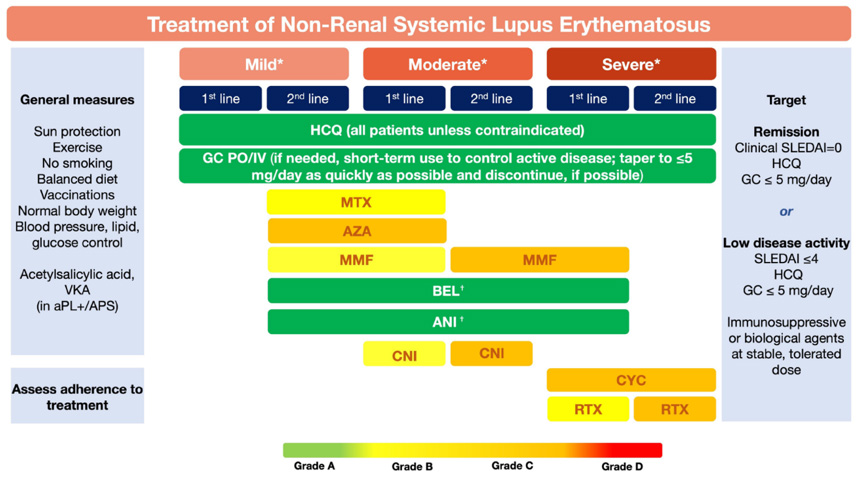
上から下の順序は優先順位を意味するものではない(MTX、AZA、MMFは、軽度では第2選択、中等症では第1選択で同等の選択肢)。
軽症:全身症状、軽度関節炎、体表面積9%以下の皮疹。血小板数5~10万/mm3、SLEDAI≤6、BILAG Cのみ、BILAG Bが一つ以下。
中等症:中等~重度の関節炎(関節リウマチ様)、体表面積9%~18%の皮疹、血小板2~5万/mm3; 漿膜炎、SLEDAI 7~12、BILAG B症状二つ以上。
重症:主要臓器を脅かす(脳炎、脊髄炎、肺炎、腸間膜血管炎)。血小板2万/mm3未満。TTP様疾患または急性血球貪食症候群。体表面積18%以上の皮疹、SLEDAI>12、BILAG A症状が一つ以上。
重篤な疾患における第一選択療法としてのベリムマブおよびアニフロルマブの推奨は、主要臓器ではないが、皮膚、関節などの広範囲の疾患を伴う腎外 SLEを指す。重症での追加としてのアニフロルマブは、主に重篤な皮膚疾患を指す。重度の精神神経疾患患者にはアニフロルマブとベリムマブは推奨されない。
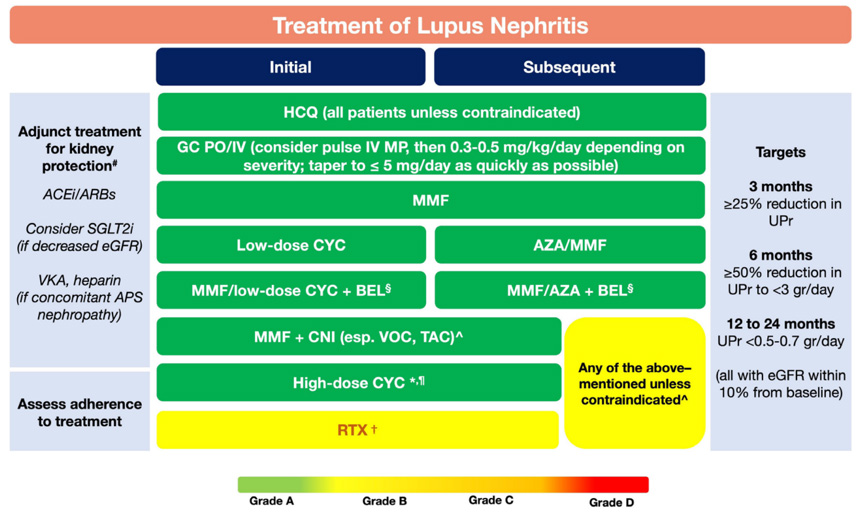
上から下の順序は優先順位を意味するものではない。一般的な腎保護薬に加え、ベリムマブは常に初期療法としてMMFや低用量IVCYと組み合わせ、維持療法として MMF または AZA と組み合わせて投与。カルシニューリン阻害剤はMMFと組み合わせて投与。高用量IVCYは予後不良因子(eGFR の低下、細胞半月やフィブリノイド壊死の組織、重度間質性炎症)が存在するループス腎炎に特に推奨される。重症のループス腎炎では月毎6回のパルスの後に隔月または四半期ごとのIVCYの延長投与。RTXは特に IVCYのレジメンに失敗した再発性/難治性疾患で考慮される。
| ステロイド | 軽症~中等症:20mg/日以下で開始。 重症~臓器を脅かす病態:mPSLパルス(250~1000mg/日を1~3日)、その後経口プレドニゾロン(0.3~0.5mg/kg/日)で開始。 維持量は5mg/日以下。 |
| ヒドロキシクロロキン (CKDで用量調整) |
目標用量5mg/kg/日(400mg/日まで)。 長期寛解状態であれば200mg/日に減量を考慮する。 |
| MTX (CKDで用量調整) |
10~25mg/週。週一日、一回あるいは2回に分けて。 |
| アザチオプリン (AZA) (CKDで用量調整) |
2~3mg/kg/日。一回あるいは2回に分けて。 寛解状態であれば2mg/kg/日以下に減量を考慮する。 投与前Nudix hydrolase 15 (NUDT15)遺伝子検査でリスク評価。 |
| ミコフェノール酸モフェチル (MMF) (CKDで用量調整) |
重症や臓器を脅かす病態、ループス腎炎初期治療:MMF2~3g/日 1回あるいは2回に分けて。 ループス腎炎の維持療法:1~2g/日、2回に分けて。 |
| シクロフォスファミド (IVCY) (CKDで用量調整) |
ループス腎炎初期療法:500mg点滴0、2、4、6、8、10週で(低用量ユーロループスレジメ)。 重症や臓器を脅かす:0.75~1g/m2体表面積/月の点滴を毎月計6回半年(高用量NIHレジメ)。 |
| シクロスポリンA (CKDでは避ける) |
1~3mg/kg/日あるいは400mg/日まで。一日2回に分けて。 |
| タクロリムス (CKDで用量調整) |
0.05~0.1mg/kg/日 あるいは2~4mg/日。一日2回に分けて。 12時間後の血中濃度目標4~6ng/ml。 |
| IVIG | 2g/kgを2~5日間 |
| アニフロルマブ | 300mg点滴。4週間毎。 |
| ベリムマブ | 10mg/kgを0、2、4週、その後は4週毎に点滴。 または、200mg/週を毎週皮下注射。 |
| 難治性の関節症状、皮膚症状などに適応外として使用されることがある | トシリズマブ、アバタセプト JAK阻害剤(血栓症や癌のリスク因子がある場合は注意。抗リン脂質抗体症候群併存では使用しない。) TNF阻害剤(薬剤性ループスを生じることがあり使用は稀) |
本邦のSLE診療の標準化を目指して、厚生労働科学研究費補助金難治性疾患等政策研究事業 自己免疫疾患に関する調査研究(自己免疫班)および日本リウマチ学会の合同で作成され南山堂から出版された。261ページからなる書籍からポイントのみ簡略したが、詳細は同書籍を参考にされたい。A~Dは証拠レベル:A (高い)、B (中)、C (低い)、D(非常に低い)、数字は合意度。
| 診断 | ACR基準、SLICC基準を参考に臨床症候と検査所見から総合的に行う。小児は「小児SLE診療の手引き」参照。 | 8.8 |
| ループス腎炎 | 国際腎臓学会/腎病理学会(ISN/RPS)分類Class III~Vは免疫抑制療法適応。Class III/IVは蛋白尿や腎機能障害と関連、Class Vは治療抵抗性蛋白尿が多い。Class III/IV特にClass III+V/IV+Vは予後不良。 | 8.8 |
| ステロイドは生命・腎予後を改善させるが、大量・長期で副作用あり免疫抑制薬を併用し必要最少・最短で投与。 | 8.7 | |
| ステロイドはSLEの全般的活動性を考慮し、尿所見と腎機能を定期モニタリングして可能な限り減量。 | 8.7 | |
| 腎炎寛解の定義は蛋白尿消失と腎機能正常が原則、長期的な正常腎機能保持のため早期寛解導入が重要。 | 8.4 | |
| Class III/IV寛解導入:PSL 0.5~1 mg/kg±mPSL pulse+MMF又はIVCY(A)。状況に応じ免疫抑制薬併用(C)。 | 8.6 | |
| Class V寛解導入:PSL 0.5 mg/kg+MMF(D)。必要に応じPSL増量(1 mg/kgまで)、IVCY、TAC(D)。 | 8.1 | |
| Class III/IV維持:必要最少ステロイド+MMF、場合によりAZP(B)、TAC(C)。 | 8.3 | |
| Class V維持:必要最少ステロイド+MMF、AZP、カルシニューリン阻害剤(C)。 | 8.3 | |
| 腎炎合併は非合併より予後不良、SLEは心血管合併症多く降圧、脂質低下、抗血栓療法など補助療法を。HCQを考慮(C)。 | 8.4 | |
| NPSLE | 各病型に応じて画像検査を参考に総合的に診断・活動性評価・治療効果判定。局所症状ではMRI、精神症状ではMRIと一般的な髄液検査を参考に、その他の原因を十分除外して診断・評価する | 8.1 |
| 寛解導入:高用量ステロイドとIVCYを臨床症候と検査所見から総合的に判断(B)。APSに伴う脳血管障害鑑別に留意。 | 8.5 | |
| 寛解導入へのRTXは既存治療抵抗性の場合の選択肢(C)。 | 8.1 | |
| 維持:AZP(D)、又はMMF(D)。 | 8.1 | |
| 皮膚症状 | 活動性評価にCLASI(cutaneous lupus erythematosus disease area and severity index)を使用。 | 7.7 |
| 診断困難例はループスバンドテスト(皮疹部や上腕内側の無皮疹部へのIgや補体の沈着)を行う(D)。 | 8.0 | |
| 部位を考慮して適切ランク(頭部weak、体幹四肢mediumやstrong、手掌足底strongest)のステロイド外用薬(C)。 | 8.5 | |
| 部位を考慮してTAC外用薬(C)。 | 8.2 | |
| 重症、広範囲、高活動性はステロイド内服(D)、皮疹のみに対して長期投与せず可能なら速やかに減量中止(D)。 | 8.1 | |
| 皮膚症状のみの治療に対して外用薬で不十分はHCQ内服(A)。 | 8.2 | |
| その他 | 関節炎:NSAIDs、少量ステロイド、HCQ、抵抗性はMTX(B)。MMF、TAC、AZPなど免疫抑制薬(D)、ベリムマブ(B)。 | 8.2 |
| 漿膜炎:中等~高用量ステロイド(C)、必要に応じIVCYなど免疫抑制薬併用(D)。 | 8.1 | |
| 溶血性貧血:高用量ステロイド(C)、抵抗例は種々免疫抑制薬(AZP、IVCY、MMF)やRTX(D)。 | 8.2 | |
| 血小板減少:ステロイドやHCQ(C)。種々免疫抑制薬(AZP、MMF、MTX、CyA、IVCY)やRTX、TPO作動薬、脾摘(D)。 | 8.1 | |
| 血栓性微小血管症(TMA):TTP(溶血、血小板減少、ADAMTS13活性<10%)では血漿交換とステロイド(C)、TTP以外では血漿交換やステロイド(D)。必要に応じIVCYなど免疫抑制薬やRTXを考慮(D)。 | 8.4 | |
| 間質性肺炎:急性はPSL 1 mg/kg±mPSL pulse、慢性進行性はPSL 0.5~1 mg/kg(D)。必要に応じ免疫抑制薬(IVCY、MMF)併用(D)。 | 8.1 | |
| 心筋炎:高用量ステロイド(C)、必要に応じ種々の免疫抑制薬(MMF、IVCY、AZP)併用(C)。 | 8.3 | |
| 動脈硬化性変化:原疾患加療+喫煙・高血圧・糖尿病・脂質代謝異常など一般的リスク因子の加療。SLEは心血管イベントリスクが高く治療目標設定する(D)。 | 8.5 | |
| 肺高血圧症:病初期のステロイドやCYを用いた免疫抑制療法(C)。必要に応じ選択的肺血管拡張薬を考慮(C)。 | 8.1 | |
| 肺動脈塞栓症:肺動脈塞栓症の標準治療に従う。疾患活動性・APS・血管炎の有無を総合評価し追加治療を考慮(C)。 | 8.3 | |
| 肺胞出血:mPSL pulse、必要に応じIVCY、血漿交換を併用(C)。びまん性肺胞出血は人工呼吸管理含む補助療法も(C)。 | 8.5 | |
| ループス腸炎:PSL 0.5~1 mg/kg(C)、必要に応じCYなど免疫抑制薬を併用(D)。 | 8.4 | |
| 膀胱炎:高用量ステロイド(C)、不十分ではmPSL pulseや種々の免疫抑制薬を併用(D)。 | 8.0 | |
| 妊娠 | 挙児希望では適切な妊娠前スクリーニングの結果に基づきカウンセリング・情報提供。リスク評価は妊娠前数ヶ月間のSLE活動性・コントロール不良、腎症・高血圧症の存在、APS合併、抗リン脂質抗体陽性。 | 8.3 |
| 妊娠判明したときは産科・内科で共に評価。流産、子宮内胎児死亡、胎児発育不全、妊娠高血圧症候群、HELLP(hemolysis、elevated liver enzymes、low platelets)症候群、前期破水など妊娠合併症と血栓症リスクが高い。APS合併例、抗リン脂質抗体陽性例では「APS合併妊娠のガイドライン」を参照。抗SSA抗体、抗SSB抗体陽性例は妊娠18週頃から超音波検査で胎児不整脈管理を行い、新生児ループス発症にも留意。 | 8.3 | |
| 妊娠高血圧腎症とSLE増悪の鑑別は難しいが、経過と各種所見を参考に総合診断する。治療・管理は産科・内科で連携し、双方の病態の治療とモニタリングを継続、適切な時期での分娩を検討。 | 8.2 | |
| 妊娠計画時にMMF、CY、MTX、ミゾリビンは中止し他剤へ変更(B)。妊娠中の薬物の中心はステロイド、HCQを必要に応じ使用(B)。不十分例はカルシニューリン阻害薬(TAC、CyA)、AZPを考慮(C)。妊娠中の中等~重度再燃時はmPSL pulseやIVIGも考慮。妊娠中・後期ならCYも考慮(D)。授乳中はMMF、CY、MTXは避ける(D)。 | 8.1 | |
| モニタリング | 疾患活動性指標、既存病変の推移、新規病変の確認、血清検査を定期的に行い疾患活動性と障害度をモニタリング。 | 8.4 |
| SLEは多彩な臓器障害を示し、総合指標と各臓器についての臨床的寛解を評価する。 | 8.4 | |
| 感染症やステロイド副作用など治療薬剤の合併症も考慮する。 | 8.4 | |
| 薬 | HCQ:皮膚症状(A)、関節症状(B)、腎症(C)を改善させる可能性あり、それらでは考慮。再発抑制に有用で新規臓器病変抑制や生命予後改善が示唆され全患者で考慮(C)。長期使用で網膜症の可能性あり定期的に眼科診察(C)。 | 8.2 |
| IVCY:Class III/IV寛解導入(A)。NPSLE(C)。その他重症病態にも検討(C~D)。CY総投与量増加は重篤合併症誘発の可能性があり注意(B)。 | 8.5 | |
| MMF:Class III/IV寛解導入(A)、維持(B)、Class V寛解導入(C)、維持(C)。腎炎以外にも治療抵抗例やステロイド減量困難例に考慮(D)。催奇形性あり挙児可能女性に投与時は避妊指導(B)。 | 8.3 | |
| カルシニューリン阻害剤:Class III/IV/V寛解導入、維持(C)。治療抵抗性血球減少やステロイド減量困難で考慮(C)。 | 8.2 | |
| RTX:NPSLEなど難治性病態を改善する可能性がありリスクベネフィット勘案して考慮(C)。 | 8.1 | |
| ベリムマブ:標準治療でも中等度以上の疾患活動性で追加(A)。しかし、NPSLEや重症ループス腎炎での効果や合併症については十分な検討がない。ステロイド減量を意図して寛解維持療法としてステロイドに併用(D)。 | 8.1 | |
| 小児 | 小児SLEは円板状皮疹、光線過敏症、関節炎、漿膜炎の頻度低いが成人例と差異は少ない。成人より重篤な可能性もあり、実際に臓器機能予後や生命予後は不良である。「小児SLE診療の手引き」参照。 | 8.1 |