大阪大学大学院医学系研究科
呼吸器・免疫内科学
Department of Respiratory Medicine and Clinical Immunology, Graduate School of Medicine, The University of Osaka
| Class I:微小メサンギウムループ腎炎 Minimal mesangial lupus nephritis |
|---|
| 光顕で糸球体は正常(メサンギウム細胞3個以内)。 蛍光抗体法でメサンギウムに免疫沈着物が認められる。蛍光抗体法や電顕で沈着を認めない時はループス腎炎としない。 |
| Class II:メサンギウム増殖性ループス腎炎 Mesangial proliferative lupus nephritis |
| 光顕でメサンギウムに限局した細胞増多(4個以上の核)、あるいはメサンギウムに限局した基質拡大を認め、メサンギウムに免疫沈着物がある。 上皮下あるいは内皮下沈着物が蛍光抗体法あるいは電顕で認められることがあっても光顕では認められない。 光顕で上皮下の沈着物を認める時はClass V、内皮下沈着物を認める時はClass III or IVを考慮する。 |
| Class III:巣状ループス腎炎Focal lupus nephritis |
| 活動性あるいは非活動性、分節性あるいは全節性の管内性または菅外性の糸球体腎炎が全糸球体の50%未満に認める。 典型的には巣状の内皮下沈着物を伴い、メサンギウム変化は伴うことも伴わないこともある。 |
| Class IV:びまん性ループス腎炎 Diffuse lupus nephritis |
| 活動性あるいは非活動性、分節性あるいは全節性の管内性または菅外性の糸球体腎炎が全糸球体の50%以上に認める。 典型的には巣状の内皮下沈着物を伴い、メサンギウム変化は伴うことも伴わないこともある。 |
| Class V:膜性ループス腎炎 Membranous lupus nephritis |
| 光顕及び蛍光抗体法あるいは電顕で、全節性あるいは分節性の上皮下免疫複合体沈着物あるいはその結果による形態学的変化が認められる。 メサンギウム病変は伴うことも伴わないこともある。 |
| Class VI:進行した硬化性ループ腎炎 Advanced sclerosing lupus nephritis |
| 90%以上の糸球体が全節性硬化を示し、非活動性の病変である。 この病変はClass III、IV、Vの進行した型であると思われる。 |
Class II + Class Vはなく、Class Vに分類される。
Class III or IV+Vとするときは、膜性変化が全節性かつびまん性に認められることが必要。
| Modified NIH activity index | 割合(配点) |
|---|---|
| 管内細胞増多 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 好中球/核崩壊 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| フィブリノイド壊死 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (2点)、25-50% (4点)、50%< (6点) |
| 硝子様沈着物 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 細胞/線維細胞性半月体 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (2点)、25-50% (4点)、50%< (6点) |
| 間質性腎炎 (皮質面積で間質性炎症のある面積) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 合計 | /24点 |
| Modified NIH chronicity index | 割合(配点) |
| 全糸球体硬化スコア (全糸球体で全節性や分節性硬化糸球体) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 線維性半月体 (全糸球体で病変のある糸球体) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 尿細管萎縮 (皮質面積で尿細管萎縮のある面積) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 間質線維化 (皮質面積で間質線維化のある面積) |
0% (0点)、<25% (1点)、25-50% (2点)、50%< (3点) |
| 合計 | /12点 |
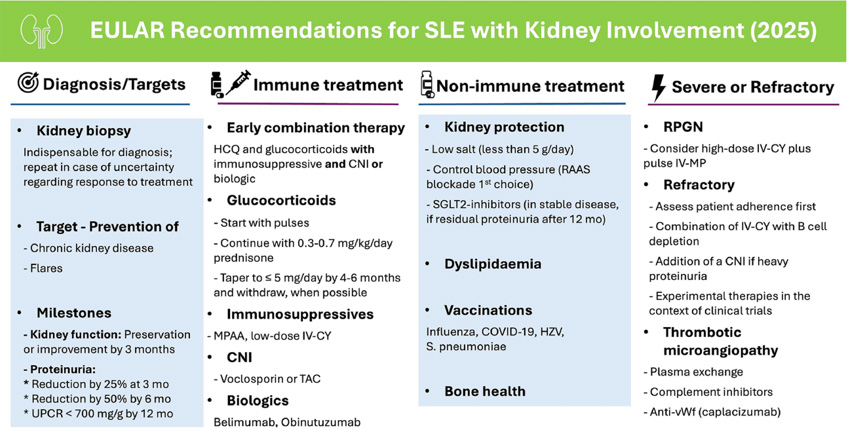
文章末の数字は同意レベル
| 包括的原則 |
|---|
| A. SLEの最適な転帰のため、腎障害の徴候(糸球体血尿、細胞円柱、蛋白尿>0.5g)や症状の定期モニタリング、専門家の助言、適時の腎生検が必要。(9.97) |
| B. 腎障害を伴うSLEはHCQを含むSLEの一般的な治療推奨に従う。(9.90) |
| C. SLEの腎障害は進行性慢性化のリスクがあり、リウマチ科と腎臓科のチームが患者と医師の情報に基づいて意思決定を共有し、進行のリスクの定期評価で最善が図られる。(9.86) |
| D. 管理目的は慢性腎臓病および腎不全の進行を予防、併存疾患に対処し、健康QOLを向上させること。免疫抑制療法と腎保護療法を含む非免疫療法の両方が必要。(9.86) |
| 推奨事項 |
| 1. 腎障害がある全患者、特に持続蛋白尿(≧0.5g/日、又は尿蛋白/Cr(UPCR≧0.5 g/g)(2b/B)、糸球体血尿(2b/C)、原因不明のGFR低下(2b/C)などで腎生検を推奨。(9.86) |
| 2. 治療は3ヶ月以内に腎機能の最適化(維持又は改善)を目指し、蛋白尿は3ヶ月までに25%減(2b/C)、6ヶ月までに50%減(2a/B)、12ヶ月までにUPCR<0.7 g/g(1b/B)を目標、その後できる限り減少させる。(9.83) |
| 3. 活動性ループス腎炎にmPSLパルス(2b/C)を推奨、その後、経口グルココルチコイド(クラスIIIとIVでは0.5〜0.7mg/kg/dayを最大4週間投与)を4~6カ月かけてプレドニゾン換算5mg/日以下に漸減(2b/C)、持続的で完全に腎炎が軽快すれば漸減中止。(9.59) |
| 4. 活動性ループス腎炎、特に予後不良因子を有するとき、 (a) MMF又は低用量IVCYとベリムマブ併用(1b/A) (b) MMFとカルシニューリン阻害薬(ボクロスポリン又はタクロリムス)併用(1b/A (c) MMFとオビヌツズマブ(抗CD20抗体。未承認)併用(1b/A) を推奨する。代替としてはMMF(1a/A)か低用量IVCY(1a/A)のいずれか単剤。(9.59) |
| 5. 急速進行性糸球体腎炎では、高用量IVCYの短期コース(修正NIHレジメン:0.5~0.75 g/m 2を毎月、6~7ヶ月)も考慮(1a/A)。(8.97 |
| 6. 腎反応後の治療は少なくとも3年間続ける(2b/B)。MMF単独(1a/A)、又はベリムマブ(1b/A)、カルシニューリン阻害薬(1b/A)、オビヌツズマブとの併用で最初に治療された場合はこれらを継続し、IVCY単独またはベリムマブとの併用で最初に治療された場合はIVCYの代わりにMMF(1a/A)かアザチオプリン(1a/A)を投与。(9.31) |
| 7. 持続的な完全腎寛解では、奏効後3年間の治療後、腎機能障害リスクを考えて免疫抑制剤や生物学的製剤の段階的な中止を考慮する(2a/B)。(9.31) |
| 8. 活動性疾患が持続、再発する患者は、上記の免疫抑制剤(2b/B)、生物学的製剤(2b/B)の切り替えと専門医への紹介を推奨。(9.72) |
| 9. 特に臨床的に不確実な場合には、治療への反応、腎臓特異的臨床検査値の悪化、免疫抑制療法の中止、を検討するため再度腎生検を考慮する (2b/B)。(9.76) |
| 10. 非免疫療法として、レニン-アンジオテンシン-アルドステロン阻害薬(持続蛋白尿、又は高血圧の場合)(5/D)、SGLT2阻害薬(持続蛋白尿、又はeGFR<60 ml/分/m²、あるいは進行性CKDの他のリスクを有する安定患者)(5/D)、スタチン(心血管リスクに基づく)(5/D)、骨保護薬(5/D)を推奨。(9.69) |
| 11. 血栓性微小血管症(抗リン脂質抗体症候群腎症、血栓性血小板減少性紫斑病様、又は補体介在性溶血性尿毒症症候群)の特徴があるときは、グルココルチコイド(mPSLパルス)(4/C)、補体阻害薬(4/C)、B細胞除去薬(4/C)、カプラシズマブ(4/C)、血漿交換(4/C)、抗凝固療法(2b/C)を考慮する。(9.52) |
| 12. 非活動性腎炎で腎外症状が適切にコントロールされている場合、妊娠前カウンセリング、妊娠に適した薬剤の投与開始、定期的な多職種による評価を行った上で、妊娠を計画することができる(1b/A)。(9.86) |
| 13. SLE患者ではあらゆる腎代替療法が選択肢である。臨床的に非活動性の腎外症状が6ヶ月以上持続する患者は移植(生体ドナー移植や先制移植を含む)を考慮する(2b/C)。(9.86) |
補足
非免疫療法として、正常体重維持、喫煙、腎毒性薬(NSAIDsなど)回避、塩分制限など生活習慣が最重要。
RAAS阻害薬は、目標血圧<130/80 mmHgや抗蛋白尿作用のため推奨。RAAS阻害薬が使えない、禁忌(高K、高BUN悪化など)、効果不十分、では作用機序の異なる降圧薬を使用。
SGLT2阻害薬は腎負荷を軽減し様々な腎臓病でGFR低下を遅らせる。持続性蛋白尿、eGFR 20~60 ml/分(20 ml/分未満は禁忌)、進行性CKDリスクがある場合、免疫抑制療法で病状が安定するまで少なくとも6~12ヶ月間は開始を延期してその後投与する。
ネフローゼ症候群および重度低Alb血症(<2-2.5 g/dL)は抗凝固療法を一時的に実施する。
HBV、HCV、結核をスクリーニングし適応があれば予防投与。インフルエンザ、肺炎球菌、SARS-CoV2、帯状疱疹などの非生ワクチン接種もすべき。
心血管疾患の予防は、脂質と他の心血管リスク因子に基づきスタチンを考慮。
骨保護と骨粗鬆症の予防はリスクに応じて、運動、正常BMIと投薬。GFR低下時にはビスホスホネートは慎重使用。
SLEのTMAは血栓性血小板減少性紫斑病(TTP)から補体介在性溶血性尿毒症症候群(CM-HUS)、抗リン脂質抗体症候群(APS)腎症がある。
TMAの組織所見、細小血管性溶血性貧血、血小板減少、中枢神経系障害でTMAと診断された場合は以下の3つを鑑別する。
ADAMTS13活性が低い場合はTTPが確定し血漿交換を推奨、その後ループス腎炎に対して免疫抑制療法を実施。カプラシズマブ(vWF因子に対する可変ドメイン)は後天性TTPに承認され難治性TTPに考慮されることがあるがSLEに関するデータは現在数件の症例報告のみである。
TTPが除外され、依然として補体活性化が疑われるCM-HUSでは、補体阻害剤 (エクリズマブおよびラブリズマブ)を考慮する。補体阻害剤は著しい腎障害を伴うCM-HUSのサブセットで有効である可能性がある。
抗リン脂質抗体陽性でTMAが存在する場合、特に高力価の場合、抗凝固療法が推奨されAPS腎症の診断となる。
GPS: Good Practice Statement(間接的なエビデンスしかないが一般的に実施されている)、S:強い推奨、C:条件付き推奨
| スクリーニング |
|---|
| SLEで既知の腎疾患がない場合6~12ヵ月毎、または腎外症状の悪化時に尿蛋白を検査する(S) |
| 腎生検 |
|
GPS:SLEでLNを疑う場合、禁忌や実施不能を除き、速やかに腎生検を行う
|
| 活動性があるLN(クラスIII/IVまたはクラスV)の適正治療 |
| GPS:LNを疑い腎生検と病理結果を待つ間、急性炎症を抑えるため速やかにGCを始める GPS:糸球体濾過量が低下している場合、LN治療薬の用量を治療の開始時や定期で調整する GPS:LNで高血栓症リスク(例:高度蛋白尿で低Alb血症)は全身抗凝固療法を腎臓内科と議論する |
| 活動性がある新規発症または再燃のクラスIII/IVまたはクラスVの場合 |
|
| 活動性の新規発症または再燃のクラスIII/IV(クラスVの有無を問わず)の場合 |
|
| 活動性のある新規発症または再燃の純粋なクラスVの場合 |
|
| 無反応性または難治性LN |
|
GPS:不十分な治療が治療無反応性の重要な原因であり、治療反応不十分や難治性のLN評価の第一段階として、薬剤の投与量およびアドヒアランスを評価する
|
| その他のループス腎臓病 |
| GPS:SLEにおける腎機能障害の他の病因を慎重に除外診断する必要がある。これには、高血圧性腎症、糖尿病性腎症、薬剤誘発性腎症など非炎症性の病因が含まれる |
| 補助療法および非免疫療法 |
| GPS:適切な免疫抑制療法に加え、補助的かつ非免疫学的な治療や診療を導入し、全体的な腎機能を向上させる。心血管、骨、感染リスク、生殖に関する問題を管理する GPS:小児発症型SLE(cSLE)および小児LNでは、cSLEの早期発症や付随する併存疾患を考えるとGC累積量の減量が極めて重要でレジメンは小児に適した量に調整する GPS:cSLEおよび小児LNでは、疾患活動性やGC治療に起因する思春期の遅延や成長速度の低下を注意深く観察し、必要に応じ小児内分泌科を紹介する GPS:cSLE患者の脆弱な移行期の悪化回避のため小児科から成人科移行を体系的・意図的に行う GPS:高齢LNは多剤併用や加齢に伴う糸球体濾過量低下を考え、種類、数、量を定期的に評価する (無反応:6~12月で少なくとも部分的な腎臓治療反応なし。治療抵抗性:標準治療2コースでも失敗) |
| モニタリング |
GPS:LNでは血清補体値と抗dsDNA抗体を受診時に月1回を超えない頻度で測定する |
| 腎代替療法 |
|
GPS:透析の開始や種類、腎移植の時期の決定は、腎臓内科との密接に連携する
|
LN:ループス腎炎、GC:グルココルチコイド、MMF:ミコフェノール酸モフェチル、CYC:シクロフォスファミド、CNI:カルシニューリン阻害剤(シクロスポリン、タクロリムス、ボクロスポリン)、RAAS-I:レニン・アンジオテンシン・アルドステロン系阻害薬(アンジオテンシン変換酵素阻害薬、アンジオテンシンII受容体拮抗薬、ミネラルコルチコイド受容体拮抗薬を含む)
慢性腎臓病(CKD)は腎臓の構造または機能の異常が3ヶ月以上継続し、健康に影響を与える状態と定義され、原因、GFR (G1~5)、およびアルブミン尿(A1~3) に基づいて分類される。

1 一般管理
| ループス腎炎の一般的管理 |
|---|
| ループス腎炎患者を含むSLEは、禁忌がない限り、HCQまたは同等の抗マラリア薬による治療を推奨する(1C)。 |
心血管リスク(禁煙、至適体重管理、運動などの生活習慣改善。脂質異常の管理。妊娠中の低用量アスピリン。血圧管理。)
蛋白尿とCKD進行(塩分過剰摂取を避ける。適正血圧管理。安定期では腎保護作用のあるRAASブロッカーやSGLT2阻害剤。腎毒性物質を避ける。AKIの予防。)
感染症リスク(帯状疱疹や結核の罹患歴評価。HBV、HCV、HIVウイルスの検索とHBVワクチン。ニューモシスティス肺炎予防。インフルエンザや肺炎球菌ワクチン。帯状疱疹組み換えワクチンの考慮。治療中には他の感染症に対する考慮。)
骨折(骨塩定量と骨折リスクの評価。CaとVitD補充。必要であればビスフォスフォネート製剤。)
紫外線暴露(日焼け止め。紫外線暴露を回避)
卵巣不全(性腺刺激ホルモン放出ホルモン類似体リュープロレリン。精子/卵子の凍結保存。)
無計画妊娠(個々で評価と避妊法のカウンセリング)
癌(悪性腫瘍のリスク因子の評価。年齢に応じた癌スクリーニング。シクロホスファミドの生涯投与を36g未満にする)
2 クラスI/IIループス腎炎
3 クラスIII/IVループス腎炎
| クラスIII/IVループス腎炎の初期治療 | ||||||||
|---|---|---|---|---|---|---|---|---|
膜様成分の有無にかかわらず、活動性クラスIII/IVでは、初期ステロイドに加えて次のいずれかの療法を行うことを推奨する。① MMF (1B)、② 低用量静脈内シクロホスファミド (1B)、③ ベリムマブと MMFまたは低用量シクロホスファミド点滴(IVCY)のいずれか (1B)、④ 腎機能が重度に障害(eGFR≦45ml/分/1.73m2) されていない場合、MMFとカルシニューリン阻害剤(CNI) (1B)。
|
ループス腎炎に対するステロイド投与量の例
| 用量 | 最初のパルス療法 | 2週毎の経口プレドニゾロン量mg/日 |
| 高用量 | mPSL0.25-0.5g/日を3日間、又はなし。 | 0.8-1.0mg/kg(max 80)、0.6-0.7mg/kg、30、25、20、15、12.5、10、7.5、7.5、5、5、25週以降は5mg未満へ。 |
| 中用量 | しばしばmPSL0.25-0.5g/日を最初3日間。 | 0.6-0.7mg/kg(max 50)、0.5-0.6mg/kg、20、15、12.5、10、7.5、7.5、5、5、21週以降は5mg未満へ。 |
| 低用量 | 通常mPSL0.25-0.5g/日を最初3日間。 | 0.5-0.6mg/kg(max 40)、0.3-0.4mg/kg、15、10、7.5、5、13週以降2.5mg、25週以降2.5mg未満へ。 |
ステロイドは免疫抑制効果と抗炎症効果があり、併用する免疫抑制剤の効果が現れるまで時間がかかるために使用される。急速進行性糸球体腎炎、中枢神経や肺障害などの重度病変がある場合、ステロイドパルスでの治療開始に一般的合意がある。ステロイドの副作用を最小にするため、最近の臨床試験は最初にステロイドパルスから開始し、より低い開始用量、経口ステロイドのより急速な漸減を行う方法が増えている。
活動性クラス III/IV ループス腎炎の初期治療におけるステロイドと併用したシクロホスファミド投与レジメ
| 高用量IVCY (NIHレジメ) |
0.5-1g/m2で毎月点滴を6ヶ月行う。 | 様々な人種を含む患者での有効性データ |
| 低用量IVCY (Euro-Lupusレジメ) |
0.5gを2週間毎に点滴を3ヶ月行う | 主にコーカシアン患者での有効性データ、いくつかはアジア人も含む |
| 経口 | 1-1.5mg/kg/日(最高150mg/日)で2-6ヶ月 | 様々な人種を含む患者での有効性データ |
| クラスIIIおよびクラスIVループス腎炎の維持療法 |
|---|
| 初期治療の完了後、維持療法でMMFを推奨する(1B)。 |
ループス腎炎での維持免疫抑制療法
| 低用量ステロイドに以下を追加 | |
|---|---|
| MMF | 高い証拠とアザチオプリンよりも低い再燃率から望ましい治療。 |
| アザチオプリン | 低医療費、妊娠中でも使用できる |
| MMF又はアザチオプリンにベリムマブ追加 | ベリムマブの有効性と安全性はBLISS-LN試験と延長試験で示されている。 |
| カルシニューリン阻害剤とMMF | ボクロスポリンの有効性と安全性はAURORA1(52週)とAURORA2試験(2年)、タクロリムスは低用量MMFを併用したマルチターゲット療法(2年)の中国人での報告。 |
| カルシニューリン阻害剤 | タクロリムスとシクロスポリンは妊娠中でも使用できる。ボクロスポリンは妊娠に関するデータ不十分。 |
| ミゾリビン | 殆どが日本人での使用 |
4 クラスVループス腎炎
5 有効性と再燃
| Complete response |
|---|
|
| Primary efficacy renal response |
|
| Partial response |
|
| No kidney response |
|
| 1 | 治療遵守を確認 |
| 2 | 可能であれば血漿薬物濃度を測定し、免疫抑制剤の適切な投与量を確保(MMF濃度をチェックや、IVCY点滴記録のチェック) |
| 3 | 慢性化または他の診断(血栓性微小血管症など)が懸念される場合は、生検を繰り返す |
| 4 | 活動性が持続する場合は、推奨されている代替治療レジメへの切り替えを検討 |
| 5 | 最初の治療レジメに抵抗性の患者では以下を検討する ・RTXまたは他の生物製剤の追加 ・IVCYの延長追加 ・適格な治療法が不十分と判断された場合は、臨床試験に参加 |
1 ループス腎炎と血栓性微小血管症(TMA)
ループス腎炎および血栓性微小血管症(TMA)の患者は、TMAの病因に応じて管理する。
ループス腎炎にTMA合併を疑う場合、ADAMTS13活性と抗ADAMTS13抗体を測定、抗リン脂質抗体を測定する。
血栓性血小板減少性紫斑病(TTP)リスク評価(PLASMICスコア)し、5点以上なら測定結果を待ちながら血漿交換とステロイドを開始する。
2 ループス腎炎患者の妊娠
3 小児におけるループス腎炎の治療
4 腎不全を伴うループス患者の管理
ループス腎炎関連慢性腎臓病(CKD)は心血管疾患や二次性免疫不全のリスクを上げる。CKD進行を抑えるには免疫因子と、非免疫リスク因子の両方に対処が必要である。制御可能な非免疫性リスク因子には、主に肥満、高血圧、塩分や蛋白質を多く含む食事、糖尿病、妊娠などネフロンの過剰濾過の原因が含まれ、腎毒性物質や喫煙も腎細胞の喪失に関与する。これら管理可能なリスク因子を制御することが大切。内因性リスク因子には、未熟児出産によるネフロン量の不足、腎症の遺伝子変異、加齢、男性、腎疾患の既往など。許容される最大量のRAS阻害剤、場合によってSGLT2阻害剤併用は残存ネフロンの過負荷を軽減できる。腎不全、心血管疾患、感染症のリスクを最小限に抑える管理は有益である。
ループス腎炎関連慢性腎臓病の進行に修正可能と修正不可能なリスク因子
| 修正可能なリスク因子 | 管理目標 |
|---|---|
| 塩分摂取 | NaCl <5g/日。 |
| 蛋白質制限 | CKD3~5では蛋白質≤0.8g/kg /日、>1.3g/kg/日を避ける。 |
| 健康的な食事 | 植物由来食品>動物由来食品、塩分の多い加工食品を最小限に、必要に応じてリン酸塩とカリウムの摂取を減らす。 |
| 身体活動 | 中程度の強度 >150分/週。 |
| 喫煙 | やめる。 |
| 糖尿病 | 1型糖尿病: HbA1c ≤7.5%、2型糖尿病: 6.5~8.5%。 |
| 太り過ぎ | BMIを25以下に下げる。 |
| 血圧 | 塩分制限とRAS阻害剤で収縮期血圧120mmHg未満に。 |
| 腎毒性物質 | NSAID、PPI、アミノグリコシド系抗生物質、造影剤はメリットがリスクを上回る場合にのみ使用。 |
| 動脈硬化性心血管疾患 | 50歳以上のCKD患者におけるスタチンまたはスタチン/エゼチミブの併用。 |
| 妊娠 | 患者の腎機能と腎機能予備能を考慮した個々の母体と胎児のリスクについてアドバイスする。 |
| 修正不可能なリスク因子 | チェック |
| ネフロン量 | 低出生体重または早産(妊娠36週未満)ですか? |
| 腎臓損傷の既往歴 | 一時的に腎機能が低下した経験はありますか? |
| 進行性CKD | CKDステージG3~5またはA2~3。 |
| 腎症遺伝子変異 | APOL1、COL4、UMOD(または既知の300を超える腎疾患遺伝子のいずれか)。 |
| 老いた腎臓 | 50歳以上。 |
| 男性の性別 | 男性は予後が悪い傾向がある。 |
ループス腎炎関連慢性腎臓病進行の非免疫機構を減弱させる薬剤
| 薬剤 | 適応 |
| レニン・アンジオテンシン系阻害剤 | 高血圧の有無にかかわらず、タンパク尿を伴う慢性腎臓病 |
| SGLT2阻害剤 | タンパク尿、肥満、2型糖尿病を伴う慢性腎臓病 |
| GLP-1作動薬 | 肥満、慢性腎臓病、2型糖尿病 |
| 非ステロイド性ミネラルコルチコイド拮抗薬 | 慢性腎臓病および2型糖尿病 |
| ジヒドロピリジン系Ca拮抗薬 | レニン・アンジオテンシン系阻害薬に加えて血圧をコントロールする |
| その他の利尿薬 | レニン・アンジオテンシン系阻害薬に加え、血圧コントロール、高カリウム血症コントロール |
| スタチン、スタチン-エゼチミブ | 50歳以上の慢性腎臓病患者 |